
实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气,某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下图所示(部分导管、蒸馏水略)。
a.Na2O2 b.浓盐酸 c.碱石灰 d.NaOH溶液 e.淀粉KI溶液 f.CaCO3 g.石蕊溶液 h.饱和NaCl溶液
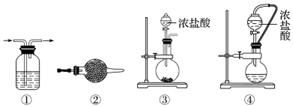
(1)写出用Na2O2与浓盐酸制备氯气的化学方程式:__________________________
________________________________________________________________________
________________________________________________________________________。
(2)下表中的装置组合最合理的是__________(填字母,需考虑实验结束撤除装置时残留有害气体的处理)。
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③⑥ | ① | ⑧/g | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/g | ① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为________________________________________________________________________。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
①________________________________________________________________________;
②________________________________________________________________________。
答案 (1)Na2O2+4HCl(浓)===2NaCl+Cl2↑+2H2O
(2)D
(3)2Na2O2+2H2O===4NaOH+O2↑(或2Na2O2+4HCl===4NaCl+2H2O+O2↑)
(4)①Na2O2能与水反应,会使原料的利用率降低 ②双氧水比Na2O2更经济 ③产生等量的Cl2,用双氧水消耗盐酸的量少 ④Na2O2能与水反应,生成的NaOH能与盐酸反应 ⑤Na2O2能与水反应,生成的NaOH吸收了Cl2(填写其中任意两条即可)
解析 Na2O2具有强氧化性,能把Cl-氧化成Cl2,制备时应把浓盐酸滴到Na2O2固体上,所以应选⑥作为制备装置,装置⑤可观察导气管是否堵塞,利用KI淀粉溶液或石蕊溶液检验Cl2,根据装置应选择⑧/g,可用NaOH溶液吸收Cl2。在此实验中,不可避免Na2O2和水反应生成O2。


科目:高中化学 来源: 题型:
无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法的名称是______________。
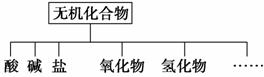
(2)
| 物质 类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②_____ | ③_____ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面。
(3)写出⑦转化为⑤的化学方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电子排布图的表述正确的是( )
A. 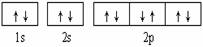 可表示单核10电子粒子基态时电子排布
可表示单核10电子粒子基态时电子排布
B. 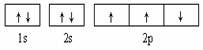 此图错误,违背了泡利原理
此图错误,违背了泡利原理
C.  表示基态N原子的价电子排布
表示基态N原子的价电子排布
D. 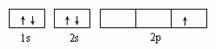 表示处于激发态的B的电子排布图
表示处于激发态的B的电子排布图
查看答案和解析>>
科目:高中化学 来源: 题型:
准晶体亦称为准晶或拟晶,是一种介于晶体和非晶体之间的固体结构。
(1)有一种由铝、铜、铁三种元素构成的天然准晶体化合物,分析该准晶体组成的一种简单方法是先将该准晶体进行粉碎,然后按如下程序进行实验:
第1步:称取38.99 g 准晶体,让其与足量的NaOH溶液充分反应,在标准状况下,收集得到21.84 L 氢气。
第2步:将第1步反应后的浊液过滤出固体,用蒸馏水洗涤,逐滴滴入6mol/L盐酸,当加入的盐酸的体积为40mL时,固体不再溶解。
①铝、铁的第一电离能的大小关系为 (用元素符号表示)。
②根据以上实验可确定该准晶体的化学式为 。
 (2)锰与一种短周期元素A形成的凝固态是一种准晶,已知A最外层电子数等于其电子层数,且其中含有成对和不成对电子。
(2)锰与一种短周期元素A形成的凝固态是一种准晶,已知A最外层电子数等于其电子层数,且其中含有成对和不成对电子。
①锰原子在基态时的核外电子排布式为 。
②锰与A在准晶体中的结合力为 。(离子键、共价键、金属键、分子间作用力)
③锰与A形成的准晶结构如图所示,则该准晶体的化学式为 。
④过渡金属配合物Mn2(CO)n的中心原子价电子数与配体提供电子总数之和为34,则n= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
明矾石

请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是____________。
(2)由溶液3制取氢氧化铝的离子方程式为_______________________________
________________________________________________________________________。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式:______________。
(4)请你写出验证溶液1中有NH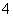 的实验过程:________________________。
的实验过程:________________________。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②检查装置A气密性的方法是___________________________________________。
③在点燃B处的酒精灯前,应进行的操作是__________________。
④装置C的作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。回答下列问题:
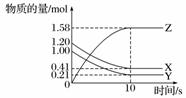
(1)从反应开始到10 s时,v(Z)=________________________________________________。
(2)反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,反应N2(g)+O2(g)2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响。(填“增大”、“减小”或“不变”)
(1)缩小体积使压强增大:__________;
(2)恒容充入N2:__________;
(3)恒容充入He:__________;
(4)恒压充入He:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均反应速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A.v(O2)=0.001 mol·L-1·s-1
B.v(NH3)=0.01 mol·L-1·s-1
C.v(NO)=0.001 mol·L-1·s-1
D.v(H2O)=0.045 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时加水稀释10 mL pH=11的氨水,下列判断正确的是( )
A.原氨水的浓度为10-3mol·L-1
B.溶液中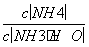 减小
减小
C.氨水的电离程度增大,溶液中所有离子的浓度均减小
D.再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com