
 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.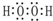 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.分析 W、X、Y、Z四种短周期元素,由元素在元素周期表中的位置,可知W、Y处于第二周期,X、Z处于第三周期,其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物,则Y为O元素,可推知W为C元素、X为P元素、Z为Cl.
(1)H2O2分子中O原子之间形成1对共用电子对、H原子与O原子之间形成1对共用电子对;主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)在图2中,将H2O2的水溶液滴入含有Fe2+和淀粉KI的水溶液,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成,说明反应生成氢氧化铁与碘单质.当消耗2molI-时,共转移3mol电子,则参加反应的Fe2+物质的量为$\frac{3mol-2mol}{3-2}$=1mol,参加反应H2O2的物质的量=$\frac{3mol}{2×[(-1)-(-2)]}$=1.5mol,故Fe2+、H2O2、I-的化学计量数之比=2:3:4,据此书写;
(3)由题意可知:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ/mol
根据盖斯定律,②-①得Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s);
(4)氯气获得电子生成Cl-,发生还原反应,应在原电池正极通入.
解答 解:W、X、Y、Z四种短周期元素,由元素在元素周期表中的位置,可知W、Y处于第二周期,X、Z处于第三周期,其中Y与钠元素和氢元素均可形成原子个数l:1和1:2的化合物,则Y为O元素,可推知W为C元素、X为P元素、Z为Cl.
(1)H2O2分子中O原子之间形成1对共用电子对、H原子与O原子之间形成1对共用电子对,其电子式为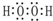 ;Z为Cl元素,处于第三周期ⅦA族,
;Z为Cl元素,处于第三周期ⅦA族,
故答案为: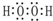 ;第三周期ⅦA族;
;第三周期ⅦA族;
(2)在图2中,将H2O2的水溶液滴入含有Fe2+和淀粉KI的水溶液,观察到烧瓶中溶液呈蓝色并有红褐色沉淀生成,说明反应生成氢氧化铁与碘单质.当消耗2molI-时,共转移3mol电子,则参加反应的Fe2+物质的量为$\frac{3mol-2mol}{3-2}$=1mol,参加反应H2O2的物质的量=$\frac{3mol}{2×[(-1)-(-2)]}$=1.5mol,故Fe2+、H2O2、I-的化学计量数之比=2:3:4,该反应离子方程式为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2,
故答案为:2Fe2++3H2O2+4I-=2Fe(OH)3↓+2I2;
(3)根据题意可知:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ/mol
根据盖斯定律,②-①得Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97kJ/mol,
故答案为:Na2O(s)+$\frac{1}{2}$O2(g)=Na2O2(s)△H=-97kJ/mol;
(4)氯气获得电子生成Cl-,发生还原反应,应在原电池正极通入,电极反应式为:Cl2+2e-=2Cl-,
故答案为:正;Cl2+2e-=2Cl-.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(3)中离子方程式书写注意根据电子转移计算确定化学计量数.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去MgCl2溶液中少量的FeCl3:加入足量的Mg(OH)2并过滤 | |
| B. | 除去NaCl溶液中少量的Na2S:加入AgCl后再过滤 | |
| C. | 除去石英中的少量碳酸钙:用稀盐酸溶解后过滤 | |
| D. | 除去氯化钠固体中的少量纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为黄绿 色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①④②⑤ | B. | ①③⑤④② | C. | ③②①⑤④ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的导电能力可能弱于弱电解质 | |
| B. | 二氧化碳的水溶液能够导电,因此二氧化碳是电解质 | |
| C. | 金属氧化物都是碱性氧化物 | |
| D. | 胶体和溶液的本质区别是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com