
分析 乙酸存在电离平衡,将其浓度稀释10倍,因电离平衡正向移动,c(H+)大于原来溶液中c(H+)的$\frac{1}{10}$.
解答 解:在相同温度下,将1mol/L的CH3COOH溶液加水稀释至原体积的10倍,则浓度变为原来浓度的$\frac{1}{10}$,所以稀释后浓度为0.01mol/L,因稀释过程中乙酸电离平衡正向移动,因此0.1mol/L乙酸溶液中c(H+)大于原溶液中c(H+)的$\frac{1}{10}$,因此前者与后者的c(H+)比值小于10.
故答案为:<;稀释过程中乙酸电离平衡正向移动,促进电离.
点评 本题考查了弱酸存在电离平衡且其浓度越小电离程度越大,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时应使温度计水银球与蒸馏烧瓶支管口平齐 | |
| C. | 蒸发时,待蒸发皿中没有水了再停止加热 | |
| D. | 称量氢氧化钠时,应先将小烧杯放在左盘称量,再将药品加入到小烧杯中称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.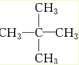 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HX、HY、HZ的酸性依次增强 | |
| B. | 溶液中的离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 电离常数K(HY)>K(HZ),水解常数K(Y-)>K(Z-) | |
| D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发法进行海水淡化 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用渗析的方法除去淀粉溶液中含有的少量NaCl | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com