
| A. | 1352 | B. | 1456 | C. | 496 | D. | 360 |
分析 根据盖斯定律①C(s)+H2O(g)═CO(g)+H2(g)△H=+130kJ•mol-1,
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
①×2-②计算水分解反应的焓变,化学反应的焓变△H=H产物-H反应物再结合化学键能和物质能量的关系来回答.
解答 解:O=O键的键能为aJ•mol-1,
已知①C(s)+H2O(g)═CO(g)+H2(g)△H=+130kJ•mol-1,
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=480kJ•mol-1,
△H=4×462-a-2×436=480kJ•mol-1,
解得a=496 kJ•mol-1,
故选C.
点评 本题考查学生盖斯定律的应用以及化学反应的能量和化学键键能之间的关系,注意知识的迁移和应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20mg/kg~40mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CHOH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2$\stackrel{Br}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{醇溶液}^{NaOH}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br}{→}$CH2BrCH2Br | |
| D. | CH2BrCH2Br$\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{Br}{→}$CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 偏大 | B. | 偏小 | C. | 无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍原子失电子的能力比钙弱 | B. | 砹的氢化物不如碘化氢稳定 | ||
| C. | 硒酸的酸性比硫酸强 | D. | 氢氧化锶的碱性比氢氧化钙强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
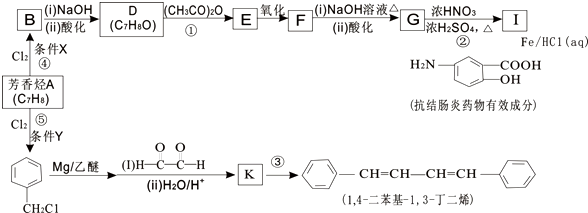
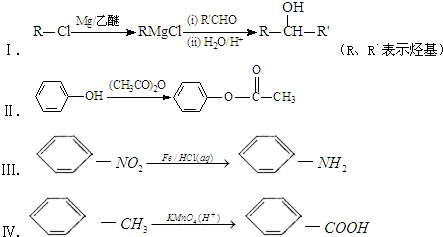
 +3NaOH→
+3NaOH→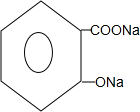 +CH3COONa+2H2O.
+CH3COONa+2H2O. 有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素.
有氯原子的方法是将少量样品与NaOH溶液在试管中混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液,若有白色白色沉淀,则证明有氯元素. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +184.6 kJ•mol-1 | B. | -92.3 kJ•mol-1 | C. | +92.3 kJ•mol-1 | D. | +92.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
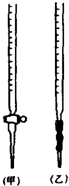 溶液中的离子反应
溶液中的离子反应查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com