
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:

| A、该反应是取代反应 |
| B、苯酚和羟基扁桃酸是同系物 |
| C、乙醛酸不能使酸性KMnO4溶液褪色 |
| D、1mol羟基扁桃酸能与2mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,16g O2和O3的混合气体所含原子数目为NA |
| B、1mol/L K2SO4溶液所含K+数目为2NA |
| C、在标准状况下,22.4L水所含分子数目为NA |
| D、7.8g Na2O2与CO2完全反应时,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
139 57 |
59 28 |
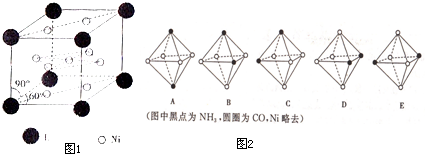
查看答案和解析>>
科目:高中化学 来源: 题型:
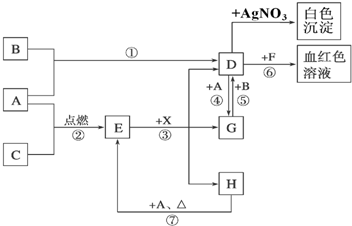
查看答案和解析>>
科目:高中化学 来源: 题型:
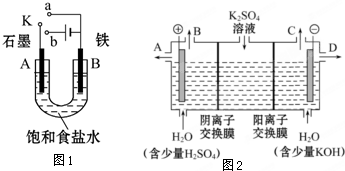 某课外活动小组用如图1装置进行实验,试回答下列问题.
某课外活动小组用如图1装置进行实验,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| +O2 |
| +O2 |
| +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
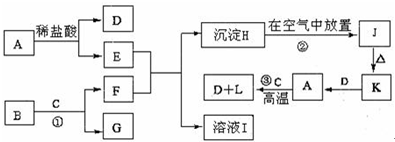
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com