
 分子中,一定在同一平面内的碳原子数为a,一定在同一直线上的碳原子数为b,处于四面体结构中心的碳原子数为c.则a,b,c依次为( )
分子中,一定在同一平面内的碳原子数为a,一定在同一直线上的碳原子数为b,处于四面体结构中心的碳原子数为c.则a,b,c依次为( )| A. | 4,5,3 | B. | 4,6,3 | C. | 6,3,4 | D. | 4,4,6 |
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | SO2具有强还原性,浓硫酸具有强氧化性,故浓硫酸不能用于干燥SO2气体 | |
| C. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 | |
| D. | Na2SO3与H2O2的反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电塑料是应用于电子工业的一种新型有机高分子材料 | |
| B. | 复合材料一般是以一种材料作基体,另一种材料作为增强体 | |
| C. | 高分子分离膜应用于食品工业中,可用子浓缩天然果汁、乳制品加工、酿造业等 | |
| D. | 合成高分子材料制成的人工器官都会受到人体的排斥作用,难以达到生物相容的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成上相差一个或若干个CH2 原子团,且符合同一通式的有机物之间互称为同系物 | |
| B. | 苯分子结构中不存在碳碳双键,因此苯不能发生加成反应 | |
| C. | 相同条件下,正丁烷、正戊烷、正己烷的沸点依次减小 | |
| D. | 皮肤上不小心沾上苯酚的浓溶液可用酒精清洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
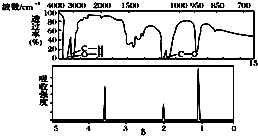
| A. | 由核磁共振氢谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由红外光谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com