
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。


(1)已知该实验反应的反应方程式为:Fe+H2O![]() Fe3O4+H2(请配平)____。
Fe3O4+H2(请配平)____。
(2)仪器a的名称是________。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃___(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6 g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448 L,则铁粉的转化率为___。
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____________ | Ⅲ.反应后的溶液中阳离子为_______ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①____________ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
【答案】3、4、1、4 干燥管 A 甲 15% Fe+2Fe3+=3Fe2+ OH-+H+=H2O H+、Fe2+
【解析】
(1)根据原子守恒配平反应的方程式;
(2)分析装置图中仪器形状和用途判断仪器名称;
(3)①高温铁和水蒸气反应,所以装置A处加热产生水蒸气,再点燃B装置处的酒精灯,根据仪器的构造特点分析判断;
②依据铁和水蒸气反应生成四氧化三铁和氢气,依据反应化学方程式定量关系计算反应的铁的质量,得到铁的转化率;
(4)依据方程式和实验现象分析判断。
(1)根据原子守恒可知该反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)根据装置图中仪器的构造可知仪器a的名称是干燥管;
(3)①高温铁和水蒸气反应,所以装置A处加热产生水蒸气,再点燃B装置处的酒精灯,甲中导气管位置错误,不能到达排水量气的目的,不可以测量生成氢气的体积,乙丙都可以利用装置测定生成气体的体积;
②称取5.6 g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448 L,生成的气体是氢气,物质的量为0.02mol,依据反应的化学方程式得到反应铁的质量为0.02mol×![]() =0.015mol,质量是0.015mol×56g/mol=0.84g,则铁粉的转化率为
=0.015mol,质量是0.015mol×56g/mol=0.84g,则铁粉的转化率为![]() ×100%=15%;
×100%=15%;
(4)向反应后的溶液中滴加KSCN溶液,溶液不变红色,溶液中不存在铁离子,这说明铁过量,生成的铁离子被铁还原生成亚铁离子,离子方程式为Fe+2Fe3+=3Fe2+;取样,滴加NaOH溶液,刚开始无明显现象,说明盐酸过量,首先发生中和反应,方程式为OH—+H+=H2O;根据离子方程式可知有氢氧化亚铁生成,又因为氢氧化亚铁易被氧化,所以实验现象是一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色,根据以上分析可知反应后的溶液中阳离子为H+、Fe2+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源A极的名称是____,丁中____(填“X”或“Y”)极颜色会加深。
(2)欲用丙装置给铜镀银,H应该是____,电镀液的主要成分是____(填化学式)。
(3)如果收集乙装置中产生的气体,相同条件下两种气体的体积比是___。
(4)甲装置为使用过的铅蓄电池,充电后电极D应与用电器的____(填“正”或“负”)极连接,电极C上的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数φ(X)随pH的变化如图所示。
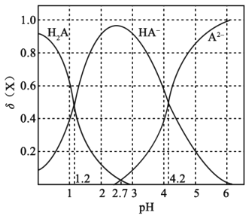
下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是

A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.工业上,B转化为D的反应条件为高温、常压、使用催化剂
D.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到有白色沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z、T四种短周期元素,原子序数依次增大。请根据下列相关信息,回答问题。
元素 | 相关信息 |
X | 原子的1s轨道上只有1个电子 |
Y | 原子的L层上s电子数等于p电子数 |
Z | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
T | 负二价的元素T的氢化物在通常情况下是一种液体,且T的质量分数为88.9% |
(1) Z2X4分子中Z原子采取________杂化,写出与之互为等电子体的有机物的结构简式_____________________
(2) Cl2T分子的空间构型___________, Z2T的电子式_________________
(3) 请用价层电子对互斥理论解释ZX![]() 和ZX3的键角∠XZX的大小:_____________。
和ZX3的键角∠XZX的大小:_____________。
(4) Y晶体的晶胞如图所示,该晶胞含有______个Y原子,若晶胞的密度为d g·cm-3,阿伏加德罗常数的值为NA(mol-1),则晶胞参数为a=_______ pm。(用含d 、NA的式子表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助太阳能将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如下图所示。下列说法不正确的是

A. 该装置可将太阳能转化为化学能
B. 催化剂b附近的溶液pH增大
C. 吸收1mol SO2,理论上能产生1mol H2
D. 催化剂a表面发生的反应为:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:___________。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图像如下。
反应条件:催化剂、一定温度、容积10 L
实验 | 起始物质的量/mol | 平衡时SO3 物质的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |

①实验ⅰ中SO2的转化率为______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,达到化学平衡状态的是________。
④ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________。
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m(m=n(SO2)/n(O2))不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型二次电池反应原理为M+3Cn(MCl4)+4MC14-![]() 4M2C17-+3Cn(M代表金属,Cn代表石墨)。装置如图所示。下列说法正确的是
4M2C17-+3Cn(M代表金属,Cn代表石墨)。装置如图所示。下列说法正确的是
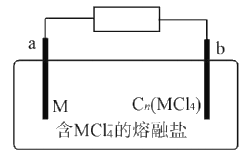
A. 放电时,MCl4-向b极迁移
B. 放电时,a极反应为M-3e-+7MCl4-=4M2Cl7-
C. 充电时,阳极反应式为Cn+MCl4-+e-=Cn(MCl4)
D. 电路上每转移lmol电子最多有3 mol Cn(MCl4)被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com