
| A. | NH4+和OH- | B. | HS-与S2- | C. | CO和N2 | D. | H2O2和K+ |
分析 质子数等于原子的质子数之和,中性微粒中质子数等于电子数,阳离子的电子数等于质子数减去电荷数,而阴离子的电子数为质子数加电荷数,据此分析.
解答 解:A.NH4+的质子数为7+1×4=11,NH4+的电子数为10,OH-的质子数为8+1=9,OH-的电子数为9+1=10,故A错误;
B.HS-的质子数等于17,电子数为18,S2-的质子数16,电子数等于18,故B错误;
C.CO和N2的质子数等于电子数等于14,故C正确;
D.H2O2的质子数等于电子数为18,K+的电子数为18,质子数为19,故D错误;
故选C.
点评 本题主要考查了微粒中质子数和电子数的确定,给出的微粒,会根据微粒的构成情况确定质子数和电子数,题目难度不大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molH2约含有6.02×1023个微粒 | |
| B. | 1mol任何物质都约含有6.02×1023个分子 | |
| C. | 32gO2和O3的混合气体中约含1.204×1024个氧原子 | |
| D. | 1mol氖气中约含有1.204×1024个氖原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
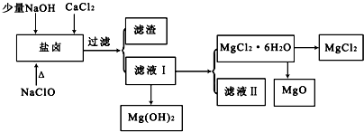
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
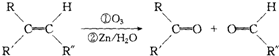
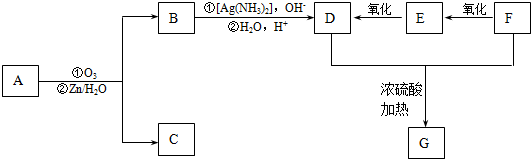
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol | |
| B. | 由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)=SO2(g):△H2,则△H1<△H2 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
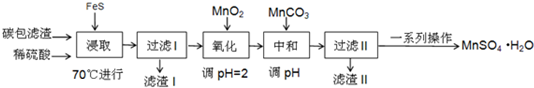
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5×10-18 | 4.6×10-14 | 2×10-54 |
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 开始沉淀时的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全时的PH | 8.4 | 3.7 | 9.8 |
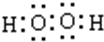 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
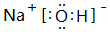 ,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com