
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示.下列判断正确的是( ) 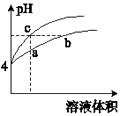
A.a、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度:a>b>c
C.b点溶液中:c(H+)+c(NH3H2O)=c(OH﹣)
D.用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb=Vc
【答案】B
【解析】解:A.溶液的导电能力和溶液中自由移动离子的多少有关,当溶液的体积相等时,a、c两点溶液的离子浓度不一样,所以导电能力不一样,故A错误;B.盐酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH<b点的pH,说明a点酸性大于b点酸性、a点氢离子大于b点氢离子,所以a、b二点溶液水的电离程度a>b,综上所述a、b、c三点溶液水的电离程度a>b>c,故B正确;
C.b点溶液中,根据质子守恒,得出c(OH﹣)+c(NH3H2O)=c(H+),故C错误;
D.用等浓度NaOH溶液和等体积b、c处溶液反应,b点为铵根水解导致溶液呈酸性,b点溶液中铵根和氢离子均消耗NaOH,而C点只有盐酸消耗NaOH(盐酸完全电离),故消耗NaOH溶液体积Vb>Vc , 故D错误.
故选B.
盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液,以此解答该题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如图1(已知2KI+Cl2=2KCl+I2 , 碘与溴一样易溶于有机溶剂):
(1)图2中A 仪器的名称是 , 仪器B中冷凝水的水流方向: .
(2)提取碘的过程中,可供选择的有机试剂是 . (填字母)
A.苯
B.四氯化碳
C.酒精
D.醋酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是( ) 
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如图探究实验:
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,若盐桥中装有饱和的KNO3溶液和琼胶制成的胶冻,则NO3﹣移向装置(填写“甲或乙”).其他条件不变,若将CuCl2溶液换为NH4Cl溶液,发现生成无色无味的单质气体,则石墨上电极反应式 . 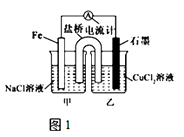
(2)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则甲装置是(填“原电池或电解池”),乙装置中石墨(2)为极,乙装置中与铁线相连的石墨(1)电极上发生的反应式为 . 
(3)在图2乙装置中改为加入CuSO4溶液,一段时间后,若某一电极质量增重 1.28g,则另一电极生成mL(标况下)气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源的开发利用与人类社会的可持续性发展息息相关.
(1)①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=a kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H2=b kJmol﹣1
O2(g)=CO2(g)△H2=b kJmol﹣1
③4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJmol﹣1
则C的燃烧热kJmol﹣1
依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号).
A.C(s)+CO2(g)═2CO(g)
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)
C.2H2O(l)═2H2(g)+O2(g)
D.2CO(g)+O2(g)═2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应: .
(2)某实验小组模拟工业合成氨反应N2+3H2 ![]() 2NH3 △H=92.4 kJmol﹣1 , 开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中.反应前压强为P.,反应过程中压强用P表示,反应过程中P/P.与时间t的关系如图2所示.请回答下列问题:
2NH3 △H=92.4 kJmol﹣1 , 开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中.反应前压强为P.,反应过程中压强用P表示,反应过程中P/P.与时间t的关系如图2所示.请回答下列问题: 
①反应达平衡的标志是(填字母代号) .
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为 .
③若提高N2的转化率可采取的措施有 .
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. 酸性:H2SO3>H2CO3B. 还原性:S2->Cl-
C. 气态氢化物的稳定性:NH3 > CH4D. Cl2从KI溶液中置换出I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜不能与稀硫酸反应,却能与浓硫酸反应,反应的方程式为:Cu+2H2SO4(浓)=CuSO4+2H2O+SO2↑
请回答:
(1)若有1mol铜反应,则参与还原反应的H2SO4物质的量为 .
(2)现用12.8g铜与足量的浓硫酸反应,可生成标准状况下SO2的体积是多少升?(写出计算过程)
(3)若用100mL 18.4mol/L的浓硫酸与足量的铜反应,却不能得到0.92mol的SO2 . 原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
CH3CH2CH2CH3(g)+ ![]() O2(g)═4CO2(g)+5H2O(l)△H=﹣2 878kJ/mol
O2(g)═4CO2(g)+5H2O(l)△H=﹣2 878kJ/mol
(CH3)2CHCH3(g)+ ![]() O2(g)═4CO2(g)+5H2O(l)△H=﹣2 869kJ/mol
O2(g)═4CO2(g)+5H2O(l)△H=﹣2 869kJ/mol
下列说法正确的是( )
A.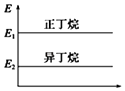
正丁烷与异丁烷的能量大小关系如图
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com