
下表各组物质中,物质之间不可能实现如图所示转化的是

选项 | X | Y | Z | M |
A | NH3 | NO | NO2 | O2 |
B | Cl2 | FeCl3 | FeCl2 | Fe |
C | Al | Al(OH)3 | NaAlO2 | NaOH |
D | NaOH | Na2CO3 | NaHCO3 | CO2 |
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:选择题
下列离子或分子在溶液中能大量共存,通入SO2后仍能大量共存的一组是
A.K+、Ca2+、Br-、Cl- B.NH3·H2O、SO32-、K+、Na+
C.Fe2+、Na+ 、K+、NO3- D.Na+ 、Mg2+、Cl-、ClO-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.pH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA
C.78 g 苯中含有碳碳双键的数目为3NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:填空题
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。



(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| Fe2+ | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
|
| X | Y |
Z | W |
|
|
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
下列有关化学用语或名称表达正确的是
A.亚硫酸的电离方程式:H2SO3 2H++SO32-
2H++SO32-
B.乙炔的分子结构模型示意图:
C.H2O2的电子式:
D. 的名称3-甲基-1-丁醇
的名称3-甲基-1-丁醇
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10 ;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) △H3
则△H3 = kJ·mol-1。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为 。

(4)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为 。
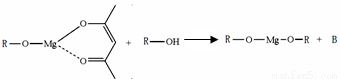
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: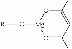 ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图:
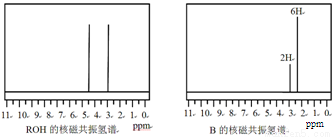
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为 ; B的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:选择题
下列叙述中不正确的是:
A.金属的电化学腐蚀比化学腐蚀普遍
B.钢铁在干燥空气里不易腐蚀
C.用铝质铆钉来接铁板,铁板易被腐蚀
D.金属腐蚀的本质是M-ne-=Mn+而被损耗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com