
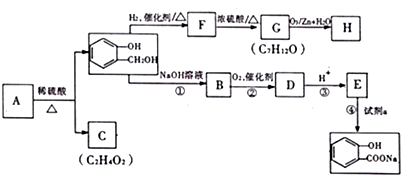
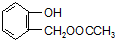 ,C含有的官能团是羧基;由F到G的反应类型为消去反应.
,C含有的官能团是羧基;由F到G的反应类型为消去反应.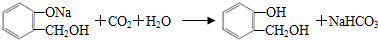 ;合适的试剂a为NaHCO3溶液.
;合适的试剂a为NaHCO3溶液.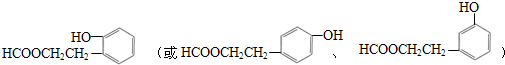 (写出一种即可).
(写出一种即可). 分析 A遇FeCl3溶液显紫色,含有酚羟基,A发生水解反应得到C与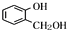 ,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166,
,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166, 的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为
的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为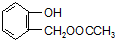 ,由转化关系可知,F为
,由转化关系可知,F为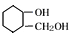 ,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成2mol单质银,则H中含有1个-CHO,则可推知G为
,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成2mol单质银,则H中含有1个-CHO,则可推知G为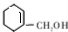 ,H为OHCCH2CH2CH2CH2COCH2OH,
,H为OHCCH2CH2CH2CH2COCH2OH, 与氢氧化钠水溶液反应生成B为
与氢氧化钠水溶液反应生成B为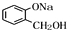 ,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为
,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为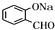 ,E为
,E为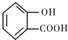 ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到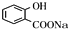 ,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,据此解答.
,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,据此解答.
解答 解:A遇FeCl3溶液显紫色,含有酚羟基,A发生水解反应得到C与 ,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166,
,可知C含有羧基,有机物A的相对分子质量是氢气相对分子质量的83倍,则Mr(A)=83×2=166, 的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为
的相对分子质量为124,故C为一元羧酸,则166+18=Mr(C)+124,故Mr(C)=60,可推知C为CH3COOH,则A为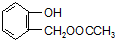 ,由转化关系可知,F为
,由转化关系可知,F为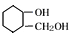 ,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成2mol单质银,则H中含有1个-CHO,则可推知G为
,G的分子式为C7H12O,则F发生消去反应得到G,G发生碳碳双键发生臭氧氧化反应生成H,若H与G分子具有相同的碳原子数,且1mol H能与足量的新制银氨溶液反应生成2mol单质银,则H中含有1个-CHO,则可推知G为 ,H为OHCCH2CH2CH2CH2COCH2OH,
,H为OHCCH2CH2CH2CH2COCH2OH, 与氢氧化钠水溶液反应生成B为
与氢氧化钠水溶液反应生成B为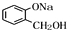 ,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为
,B发生催化氧化生成D,D与银氨溶液发生氧化反应,酸化得到E,则D为 ,E为
,E为 ,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到
,反应①的目的是保护酚羟基,防止在反应②中被氧化,E与是a反应得到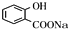 ,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
,反应中羧基发生反应,而酚羟基不反应,故试剂a为NaHCO3溶液,
(1)由上述分析可知,A的结构简式为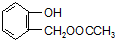 ,C为CH3COOH,含有的官能团为羧基,由上述发生可知F到G的反应类型为 消去反应,
,C为CH3COOH,含有的官能团为羧基,由上述发生可知F到G的反应类型为 消去反应,
故答案为: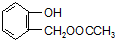 ;羧基;消去反应;
;羧基;消去反应;
(2)由上述分析可知,H为OHCCH2CH2CH2CH2COCH2OH,
故答案为:OHCCH2CH2CH2CH2COCH2OH;
(3)反应①的作用是:是保护酚羟基,防止在反应②中被氧化,
故答案为:保护酚羟基,防止在反应②中被氧化;
(4)B溶液与少量CO2反应的化学方程式为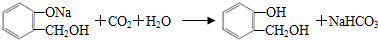 ,合适的试剂a为NaHCO3溶液,
,合适的试剂a为NaHCO3溶液,
故答案为: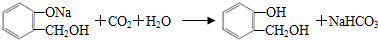 ;NaHCO3溶液;
;NaHCO3溶液;
(5)同时满足下列条件的A(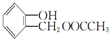 )的同分异构体:Ⅰ.与A有相同的官能团,含有羟基、酯基;Ⅱ.苯环上只有两个取代基,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,则符合上述条件的结构为苯环上连有-OH和另一个侧链为-CH2CH2OOCH、-CH(CH3)OOCH、-CH2OOCCH3、-OOCCH2CH3、-CH(CH3)OOCH、-COOCH2CH3、-CH2COOCH3,每种都有邻间对三种,所以除了A外还有17种,其中无甲基(-CH3)的同分异构体的结构简式为
)的同分异构体:Ⅰ.与A有相同的官能团,含有羟基、酯基;Ⅱ.苯环上只有两个取代基,Ⅲ.遇FeCl3溶液显紫色,含有酚羟基,则符合上述条件的结构为苯环上连有-OH和另一个侧链为-CH2CH2OOCH、-CH(CH3)OOCH、-CH2OOCCH3、-OOCCH2CH3、-CH(CH3)OOCH、-COOCH2CH3、-CH2COOCH3,每种都有邻间对三种,所以除了A外还有17种,其中无甲基(-CH3)的同分异构体的结构简式为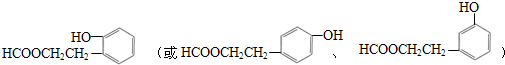 ,
,
故答案为:17;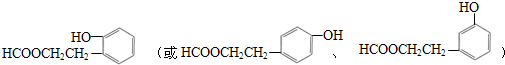 .
.
点评 本题考查有机物推断与合成,难度中等,关键是A的结构的确定,根据题中的反应条件及有关分子式进行推断,对学生的分析推理有一定的要求,需要学生熟练掌握官能团的性质与转化.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2、CsCl、CF4、CBr4 | B. | CsCl、SiO2、CBr4、CF4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
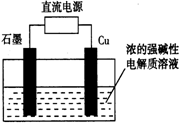 Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )
Cu2O可由电解制取,如图所示,电解总反应:2Cu+H2O=Cu2O+H2↑.下列说法正确的是( )| A. | 石墨电极上产生氢气 | B. | 铜电极发生还原反应 | ||
| C. | 铜电极接直流电源的负极 | D. | 该反应也可设计为原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中通入少量的氯气:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Al2(SO4)3中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 碳酸氢氨溶液和过量NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m:n=2:1 | B. | m=2x | C. | x:m:n=1:2:1 | D. | m=2x+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ka=1.8×10-5 |
| H2SO3 | Ka1=1.23×10-2 Ka2=6.6×10-8 |
| NH3.H2O | Kb=1.8×10-5 |
| A. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的 | |
| B. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过渡元素中,可以找到半导体材料 | |
| B. | 在ⅠA、ⅡA族元素中,寻找制造农药的主要元素 | |
| C. | 在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料 | |
| D. | 为元素性质的系统研究提供指导,为新元素的发现提供线索 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
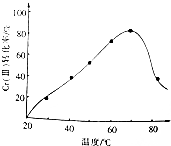 工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.
工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀,利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com