
| ||
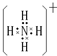 ,铵根离子在加热条件下,可以和强碱溶液反应生成氨气,据此检验即可,即(取适量的乙溶于水) 加氢氧化钠溶液,加热,把湿润的红色石蕊试纸放在试管口,试纸变蓝,
,铵根离子在加热条件下,可以和强碱溶液反应生成氨气,据此检验即可,即(取适量的乙溶于水) 加氢氧化钠溶液,加热,把湿润的红色石蕊试纸放在试管口,试纸变蓝, ;(取适量的乙溶于水) 加氢氧化钠溶液,加热,把湿润的红色石蕊试纸放在试管口,试纸变蓝;
;(取适量的乙溶于水) 加氢氧化钠溶液,加热,把湿润的红色石蕊试纸放在试管口,试纸变蓝;

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| A、Sn2+、Fe2+、Ge3+ |
| B、Sn2+、Ge3+、Fe2+ |
| C、Ge3+、Fe2+、Sn2+ |
| D、Fe2+、Sn2+、Ge3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2和H2在点燃或光照条件下可合成氨 |
| B、氨是共价化合物,硝酸是离子化合物 |
| C、氨气遇到浓硝酸会发生反应产生白烟 |
| D、由氨制取硝酸过程中,氮元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |||
| M | Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:
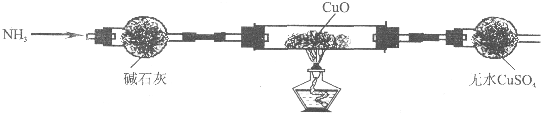
查看答案和解析>>
科目:高中化学 来源: 题型:
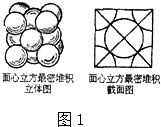 (1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是
(1)现有以下几种物质::①晶体二氧化硅②干冰③五氯化磷④金刚石⑤过氧化钠⑥冰⑦碳化硅⑧白磷;请用编号填写:通过非极性键形成原子晶体的是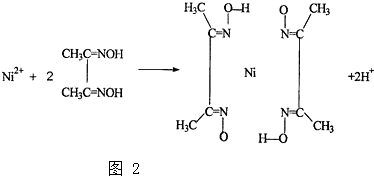
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com