
【题目】在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为__________ mol,其中CO2为__________mol,CO占总体积的__________,混合气体的摩尔质量为__________。
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是
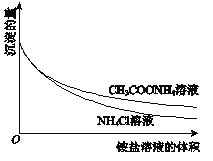
A. Mg(OH)2浊液中存在:Mg(OH)2(s)![]() Mg2+(aq)+2OH﹣(aq)
Mg2+(aq)+2OH﹣(aq)
B. ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3H2O
C. H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D. ③中获得的图象与②相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
化学键 | N≡O (NO) | Cl-Cl | Cl-N | N=O |
键能/(kJ/mol) | 630 | 243 | a | 607 |
则反应2NO(g)+Cl2(g)2ClNO(g)的ΔH和a的关系为ΔH= _______________kJ/mol。
(3)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
n=________________;k=__________________________。
(4)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是______________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:
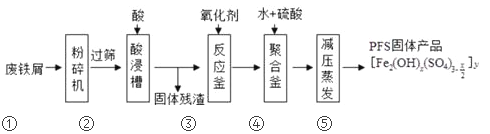
下列说法不正确的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
C. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
D. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。
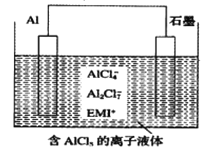
①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) △H1=a kJ·mol-1
②3AlCl(g)===2A1(1)+AlCl3(g) △H2=b kJ·mol-1
③Al2O3(s)+3C(s)===2A1(1)+3CO(g) △H3
下列说法正确的是
A. 该电池放电时的负极反应方程式为A1-3e-+7AlCl4-===4A12C17-
B. ΔH2<0
C. 该电池充电时石墨电极与电源负极相连
D. A12O3(s)+3C(s)===2A1(1)+3CO(g) ΔH3=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期的元素,其原子序数依次增大,A为元素周期表中原子半径最小的元素,B的基态原子中占有电子的3个能级上的电子数均相等,D与B同族,C与B同周期,且C的所有p轨道上的电子数与所有s轨道上的电子数相等,E的次外层电子数是其最外层电子的7倍。
回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为___________;(用元素符号表示),D元素基态原子价层电子排布式为______________________;
(2)A、C形成的三原子分子中,C原子的杂化方式为___________;
(3)C、D形成的化合物的晶体类型为___________;
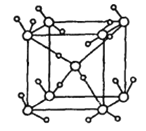
(4)金属Mg与A、E形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表E,灰球代表Mg,白球代表A,其中白球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:______________________。
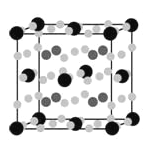
(5)B、C、E能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和黑球代表。
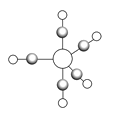
该配合物形成配位键时提供空轨道的原子是___________(填元素符号),该配合物中大白球代表的元素的化合价为___________。
①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+:______________________
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若平衡体系A+B![]() C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )
C+D,增大压强时反应速率变化如图所示。则下列关于各物质状态的说法正确的是( )

A.A、B、C、D都是气体
B.C、D都是气体,A、B中有一种是气体
C.A、B都不是气体,C、D中有一种是气体
D.A、B都是气体,C、D中有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的容器中充入2molA和1molB发生反应:2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
A. 2 B. 3 C. 2或3 D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com