
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中[H+]的增大而加快。
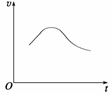
(1) 反应开始时反应速率加快的原因是
________________________________________________________________________
________________________________________________________________________
________________;
(2) 反应后期反应速率减慢的原因是
________________________________________________________________________
________________________________________________________________________。
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得两端导线中均通过0.02 mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
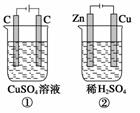
A.产生气体的体积:①>②
B.两极上析出物质的质量:②>①
C.溶液的pH变化:①增大,②减小
D.电极反应式①中阳极:4OH-—→2H2O+O2↑+4e-;②中阴极:2H++2e-—→H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如:
反应①
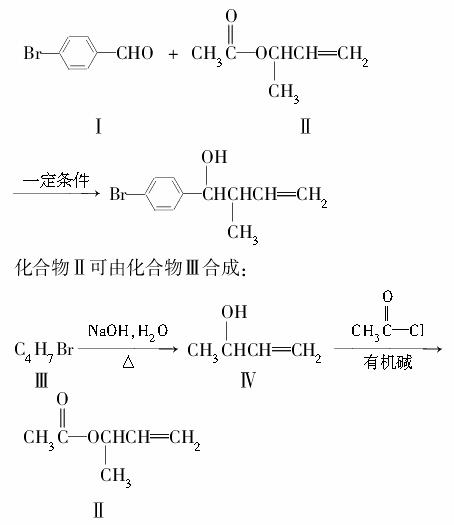
(1)化合物Ⅰ的分子式为________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为________。
(3)化合物Ⅲ的结构简式为________。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为____________________________(注明反应条件)。因此,在碱性条件下,由Ⅳ与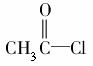 反应合成Ⅱ,其反应类型为________。
反应合成Ⅱ,其反应类型为________。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应。Ⅴ与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为________(写出其中一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用如下图所示装置进行下列实验。
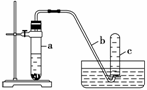
(1)在检查装置气密性后,向试管a中加入10 mL 6 mol·L-1硝酸和1 g Cu片,立即将带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式
________________________________________________________________________
________________。
(1) 实验过程中反应开始时速率缓慢,随后逐渐加快,这是由于
________________________________________________________________________,
当反应进行一段时间后速率又逐渐减慢,原因是
________________________________________________________________________
________________________________________________________________________。
(3)欲较快地制得NO,可采取的措施是( )
A.加热 B.使用铜粉 C.稀释HNO3 D.改用浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2发生反应:N2+3H2
 2NH3,2 min时,测得剩余N2为1 mol,对于这个化学反应的反应速率表示不正确的是( )
2NH3,2 min时,测得剩余N2为1 mol,对于这个化学反应的反应速率表示不正确的是( )
A.v(N2)=0.25 mol·L-1·min-1
B.v(H2)=0.75 mol·L-1·min-1
C.v(NH3)=0.5 mol·L-1·min-1
D.v(N2)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在N2(g)+3H2(g)
 2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
A.改变条件后速率—时间图象如右图: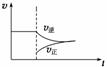
B.此过程中Q>K
C.平衡体系中NH3的含量增大
D.N2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)===2NH3(g)+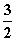 O2(g)
O2(g)
ΔH=765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:
________________________________________________________________________
________________________________________________________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 。计算:
。计算:
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)
 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是(双选)( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的氧化性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为H2CO3在加入强酸或强碱溶液溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
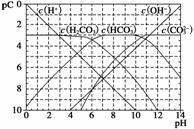
(1)在人体血液中,HCO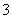 能起到使人体血液pH保持在7.35~7.45的作用。
能起到使人体血液pH保持在7.35~7.45的作用。
①请用电解质溶液中的平衡解释:__________________(用离子方程式表示)。
②正常人体血液中,HCO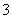 的水解程度________电离程度(填“<”、“>”或“=”)。
的水解程度________电离程度(填“<”、“>”或“=”)。
③pH=7.00的血液中,c(H2CO3)________c(HCO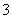 )(填“<”、“>”或“=”)。
)(填“<”、“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值Ka1≈________。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO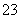 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确______________________。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确______________________。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1、c(CO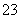 )=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com