
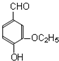
 )是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
)是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
. )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
 .
.分析 (1)乙基香草醛分子中的含氧官能团有乙氧基、酚-OH、-CHO,由结构可知不对称,有7种位置的H原子;
(2)由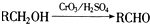 ,B能发生银镜反应,所以B中含有醛基,所以A中含有-CH2OH结构,A可以被氧化为苯甲酸,说明与苯环直接相连的碳原子上有氢,且苯环的侧链只一个,A中含有三个氧原子,羟基占一个,所以还含有羧基,故A的结构简式为
,B能发生银镜反应,所以B中含有醛基,所以A中含有-CH2OH结构,A可以被氧化为苯甲酸,说明与苯环直接相连的碳原子上有氢,且苯环的侧链只一个,A中含有三个氧原子,羟基占一个,所以还含有羧基,故A的结构简式为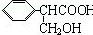 ,则A和HBr之间发生取代反应,生成的C为
,则A和HBr之间发生取代反应,生成的C为 ,则B为
,则B为 ;
;
(3)根据有机物质结构和官能团以及碳个数的变化来确定有机合成路线;
(4)根据条件①能与NaHCO3溶液反应,说明有羧基,②遇FeCl3溶液显紫色,且能与浓溴水反应,说明有酚羟基,且酚羟基的邻对位苯环上至少有一个氢原子,③苯环上有两个烃基,④苯环上的官能团处于对位,注意烃基不是官能团,据此写乙基香草醛的同分异构体.
解答 解:(1)乙基香草醛分子中的含氧官能团有乙氧基、酚-OH、-CHO,酚-OH名称为酚羟基,-CHO名称为醛基,由结构可知不对称,有7种位置的H原子,则核磁共振谱表明该分子中有7种不同类型的氢原子,
故答案为:酚羟基;醛基;7;
(2)由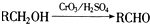 ,B能发生银镜反应,所以B中含有醛基,所以A中含有-CH2OH结构,A可以被氧化为苯甲酸,说明与苯环直接相连的碳原子上有氢,且苯环的侧链只一个,A中含有三个氧原子,羟基占一个,所以还含有羧基,故A的结构简式为
,B能发生银镜反应,所以B中含有醛基,所以A中含有-CH2OH结构,A可以被氧化为苯甲酸,说明与苯环直接相连的碳原子上有氢,且苯环的侧链只一个,A中含有三个氧原子,羟基占一个,所以还含有羧基,故A的结构简式为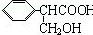 ,则A和HBr之间发生取代反应,生成的C为
,则A和HBr之间发生取代反应,生成的C为 ,则B为
,则B为 ,
,
①由A→C的反应方程式为  ,属于取代反应,
,属于取代反应,
故答案为: ;取代反应;
;取代反应;
②由上述分析可知,B的结构简式为 ,
,
故答案为: ;
;
③在加热条件下C与NaOH水溶液发生反应的化学方程式为: ,
,
故答案为: ;
;
(3)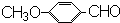 合成
合成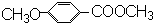 的过程为:先将醛基氧化为羧基,然后让所及和醇之间发生酯化反应即可,流程为
的过程为:先将醛基氧化为羧基,然后让所及和醇之间发生酯化反应即可,流程为 ,
,
故答案为: ;
;
(4)乙基香草醛除苯环外,还有3个C原子,3个O原子,4个H原子,条件①说明有羧基,条件②说明有酚羟基且酚羟基的临位和对位必须有空位,条件④说明羧基和酚羟基在对位,则剩余两个甲基不能都在酚羟基的临位,可见其同分异构体有: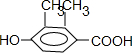

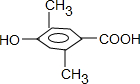 3种,其中核磁共振氢谱中出现4组峰,吸收峰的面积之比为1:1:2:6的,符合条件的为
3种,其中核磁共振氢谱中出现4组峰,吸收峰的面积之比为1:1:2:6的,符合条件的为 ,
,
故答案为:3;  .
.
点评 本题考查有机物的推断,题目难度中等,注意把握有机物中的官能团分析发生的反应,明确结构与性质的关系来推断各物质,试题充分考查了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.
室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室.分别向A、B两室充入H2、O2的混合气体和1mo1空气.此时活塞的位置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 完全沉淀时pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应2A+B?2C(g)△H<O,在一密闭容器中进行,随T(℃)变化容器中气体平均相对分子质量$\overline{M}$r的变化如图所示,则下列叙述中正确的是( )
可逆反应2A+B?2C(g)△H<O,在一密闭容器中进行,随T(℃)变化容器中气体平均相对分子质量$\overline{M}$r的变化如图所示,则下列叙述中正确的是( )| A. | A和B可能都是固体 | |
| B. | A和B一定都是气体 | |
| C. | A和B可能都是气体 | |
| D. | 随温度的升高,容器中的压强一定在减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (填写电子式).
(填写电子式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、BaCl2、HCl | B. | BaCl2、Na2CO3、HCl | ||
| C. | BaCl2、Na2CO3、HNO3 | D. | BaCl2、K2CO3、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S+H2SO4(浓) | B. | Cu+H2SO4(浓) | C. | C+H2SO4 (浓) | D. | CuO+H2SO4 (浓) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2ΝΗ3(g)+CO2(g)
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2ΝΗ3(g)+CO2(g)| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总 浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com