
| A. | 等质量的铜分别与足量稀硝酸和浓硝酸充分反应,生成气体的物质的量相同 | |
| B. | 等质量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同 | |
| C. | 等质量的铝分别与足量氢氧化钠溶液和盐酸充分反应,生成气体的体积一定相同 | |
| D. | 等质量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同 |
分析 A.分别发生Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
B.分别发生2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS;
C.分别发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al+6HCl=2AlCl3+3H2↑;
D.分别发生Cl2+2NaOH=NaCl+NalO+H2O、Cl2+Na2S=2NaCl+S,等质量时物质的量相同,结合反应计算.
解答 解:A.等质量的Cu,设Cu均为1mol,则与足量稀硝酸和浓硝酸充分反应,生成的气体分别为2mol、$\frac{2}{3}$mol,故A不选;
B.等质量的Fe,设Fe均为2mol,由2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS可知,生成物均为2mol,故B选;
C.等质量的Al,设Al均为2mol,与足量氢氧化钠溶液和盐酸充分反应,生成气体均3mol,但状况不一定相同,则体积不一定相同,故C不选;
D.等质量的氯气,设均为1mol,由Cl2+2NaOH=NaCl+NalO+H2O、Cl2+Na2S=2NaCl+S可知,转移电子分别为1mol、2mol,故D不选;
故选B.
点评 本题考查金属及化合物的综合应用,为高频考点,把握发生的反应及氧化还原反应的分析为解答的关键,侧重分析、计算及应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变 | |
| B. | NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强 | |
| C. | SO3(g)+H2O(l)═H2SO4(aq)在常温下能自发进行,则该反应的△H<0 | |
| D. | 0.1 mo1•L-1 CH3COOH溶液加水稀释后,溶液中$\frac{{c(CH}_{3}C{OO}^{-1})}{{c(CH}_{3}COOH)}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO32-)>c(HCO3-) | |
| D. | 0.2 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(CO32-)+c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置,分液,得到下层液体 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 通常用产生气泡的快慢,比较不同条件下Na2S2O3溶液与稀硫酸反应速率 | |
| D. | 用pH计分别测定0.1mol/L的FeCl3和0.01mol/L的FeCl3的pH,可以比较浓度对盐类水解程度的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
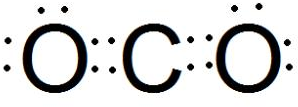 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
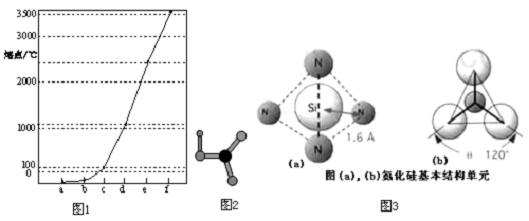
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成; 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
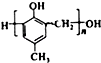 ,化合物C和化合物N的合成路线如下:
,化合物C和化合物N的合成路线如下: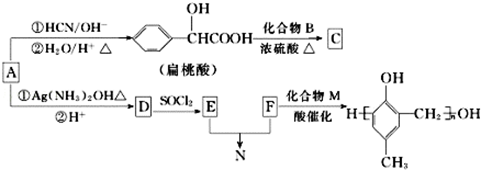
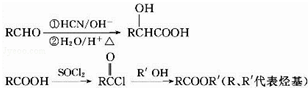
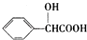
 ,D的含氧官能团的名称是羧基.
,D的含氧官能团的名称是羧基. .
.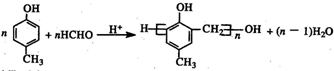 .
.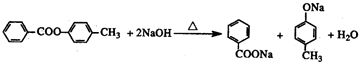 .
. )有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有10种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式
)有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有10种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式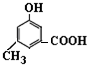 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com