
分析 ①碳酸钙不溶于水;
②碳酸钙不稳定,加入可分解生成氧化钙;
③酒精和水互溶,二者沸点不同;
④水和CCl4的混合物分层;
⑤NaCl和KNO3的溶解度随温度变化不同.
解答 解:①碳酸钙不溶于水,可用过滤的方法分离,故答案为:a;
②碳酸钙不稳定,加入可分解生成氧化钙,可用加热的方法除杂,故答案为:d;
③酒精和水互溶,二者沸点不同,可用蒸馏的方法分离,故答案为:c;
④水和CCl4的混合物分层,可用分液的方法分离,故答案为:e;
⑤NaCl和KNO3的溶解度随温度变化不同,可用重结晶的方法分离,故答案为:b.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意分离方法的选择,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
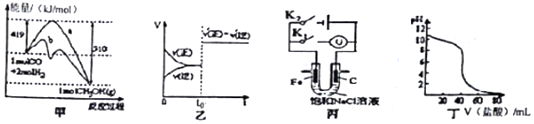
| A. | 图甲表示工业上用CO生成甲醇的反应CO(g)+2H2(g)?CH2OH(g),该反应的△H=-91kJ•mol-1 | |
| B. | 图乙表示已达到平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂 | |
| C. | 图丙中若K1闭合,石墨棒周围溶液pH逐渐升高;若K2闭合,电路中通过0.002NA个电子时,两极理论上共产生0.002mol气体 | |
| D. | 图丁表示盐酸滴加0.1 mol•L-1NaOH溶液的得到的滴定曲线,该实验的指示剂最好选取酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Br2(g)?2HBr(g) | B. | N2(g)+3H2(g)?2NH3(g) | C. | 2SO2(g)+O2(g)?2SO3(g) | D. | C(s)+CO2(g)?2CO(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 土壤胶体带负电荷,有利于铵态氮肥的吸收 | |
| B. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码)过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+﹑Ca2+﹑Cl-﹑CO32- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Cu2+﹑Cl-﹑Ca2+﹑NO3- | D. | NO3-﹑Na+﹑Ca2+﹑Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com