
【题目】某温度(T℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,该温度下水的KW= 。该温度(填“大于”、“小于”或“等于”) 25℃,其理由是 。
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va:Vb= 。
(2)若所得混合溶液为中性,且a+b=12,则Va:Vb= 。
(3)若所得混合溶液的pH=10,且a=12,b=2,Va:Vb= 。
【答案】10-22;大于;水的电离是吸热的,升温时水的电离平衡正向移动,KW增大,因该温度下的KW大于25℃时水的KW=1×10-14,所以该温度大于25℃
(1)1:10;(2)10:1;(3)1:9。
【解析】
试题分析:0.01molL-1的NaOH溶液的pH为11,则氢离子浓度=10-11 mol/L,氢氧化钠是强电解质完全电离,所以溶液中氢氧根离子浓度是0.01mol/L,则Kw=c(H+).c(OH-)=0.01×10-11=10-13,水的电离是吸热的,升温时水的电离平衡正向移动,KW增大,因该温度下的KW大于25℃时水的KW=1×10-14,所以该温度大于25℃,故答案为:10-13;大于;水的电离是吸热的,升温时水的电离平衡正向移动,KW增大,因该温度下的KW大于25℃时水的KW=1×10-14,所以该温度大于25℃;
(1)若所得混合溶液为中性,且a=12,b=2,因c(OH-)×Va=c(H+)×Vb,a=12,b=2,则0.1×Va=0.01Vb,则Va:Vb=1:10故答案为:1:10;
(2)若所得混合液为中性,且a+b=12,Va:Vb=![]() =1013-a-b=10,则Va:Vb=10:1,故答案为:10:1
=1013-a-b=10,则Va:Vb=10:1,故答案为:10:1
(3)若所得混合溶液的pH=10,碱过量,且a=12,b=2,则溶液中c(OH-)=![]() =0.001,则Va:Vb=1:9;故答案为:1:9。
=0.001,则Va:Vb=1:9;故答案为:1:9。


科目:高中化学 来源: 题型:
【题目】已知碳元素的单质有金刚石、石墨和足球烯(C60)等,含氧元素的单质有O2、O3,下列说法不正确的是( )
A.一种元素可以形成两种或两种以上不同的单质
B.单质的种类一定多于元素的种类
C.只含有一种元素的物质不一定是纯净物
D.只含有碳元素的物质在氧气中燃烧只能生成一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某卤代烃(R-X)中的 X 元素,下列操作:(1)加热煮沸;(2)加入 AgNO3 溶液;(3)取少量该卤代烃;(4)加入足量稀硝酸酸化;(5)加入 NaOH 溶液;(6)冷却。正确的操作顺序是( )
A. (3) (1) (5) (6) (2) (4) B. (3) (5) (1) (6) (2) (4)
C. (3) (2) (1) (6) (4) (5) D. (3) (5) (1) (6) (4) (2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
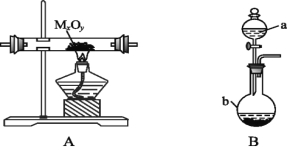

(1)仪器a的名称为 ,仪器b中装入的试剂可以是 。
(2)按气流方向正确的装置连接顺序为(填序号,装置可重复使用): 。
(3)装置C的作用: 。
(4)实验结束时,应首先 (填序号);这样做的原因是 。
Ⅰ.熄灭A装置的酒精灯 Ⅱ.停止从a中滴加液体
(5)若金属氧化物为CuO,反应的化学方程式为 。
(6)若实验中准确称取金属氧化物的质量为m g,完全反应后,测得生成水的质量为n g,则M的相对原子质量为 (用含x、y、m、n的式子表示)。
(7)某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2Al(s)+O2(g)=Al2O3(s) △H=-1644.3kJ·mol-1
2Fe(s)+O2(g)=Fe2O3(s) △H=-815.88kJ·mol-1
写出铝粉与氧化铁粉末发生铝热反应的热化学方程式 。
(2)高铁酸钾(K2FeO4)在水中的反应为4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
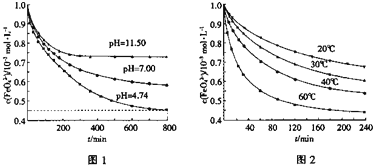
①pH=4.74时,反应从开始到800min时平均反应速率v(OH-)= 。
②图1在800min后,三种溶液中的c(FeO42-)均不再改变。随着pH的变大,此反应的平衡常数K (填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中FeO42-的浓度不再变化,下列说法正确的是
a.上述反应的△H>0 b.升高温度,该反应pH减小
c.温度越高,反应速率越慢 d.加入盐酸,FeO42-的浓度减小
④FeO42-在水溶液中的存在形态如图3所示。下列说法正确的是
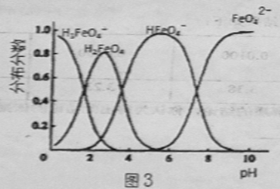
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐变大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
已知:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是 。
(3)常温常压下,饱和氯水中氯气总浓度约为0.09mol/L,且存在可逆反应:Cl2 + H2O ![]() HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O
HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O![]() HCl+HClO的平衡常数为 。
HCl+HClO的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据结构对有机物进行分类,有助于对其性质的掌握。
A.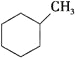 B.
B.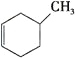 C.
C.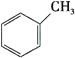
上述有机物属于芳香烃的是____________ (填字母),它与苯的关系是____________,
写出苯与溴发生反应的化学方程式___________________,
Ⅱ.下列几组物质中,互为同位素的有____________,
互为同素异形体的有___________,
互为同系物的有____________,
互为同分异构体的有____________,
属于同种物质的有____________。
①O2和O3 ②35Cl和37Cl
③![]() 和
和![]()
④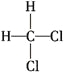 和
和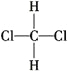
⑤CH3(CH2)2CH3和(CH3)2CHCH3
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是
![]()
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3,则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com