
| A.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42—)>c(OH—)=c(H+) |
| B.25℃时,NaB溶液的pH=8,c(Na+) + c(B-)=9.9×10-7mol·L-1 |
| C.0.1mol·L-1的NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
| D.同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa)<c(Na2CO3) |
 HB+OH-。pH=8,c(H+)=10-8mol/Lc(OH-)=10-6mol/L根据溶液呈电中性原理c(Na+) + c(H+)=c(B-)+ c(OH-),c(Na+) -c(B-)=c(OH-)-c(H+)=9.9×10-7mol/L.错误。C.根据电荷守恒可得c(Na+) + c(H+)= c(OH-)+ 2c(CO32-)+ c(HCO3-);根据物料守恒可得c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)。代入第一个式子可得c(OH-)+c(CO32-)=c(H+)+c(H2CO3)。正确。D对于同种浓度的强碱弱酸盐,酸越强,盐水解的程度就越小,盐溶液的pH就越小。若同温下,pH相同时,则生成盐的酸的酸性越强,该酸产生的盐的浓度就越大。酸性:CH3COOH> H2CO3>C6H5OH> HCO3-.所以同温下,pH相同时,溶液物质的量浓度c(CH3COONa) >c(NaHCO3) >c(C6H5ONa) >c(Na2CO3)。错误。
HB+OH-。pH=8,c(H+)=10-8mol/Lc(OH-)=10-6mol/L根据溶液呈电中性原理c(Na+) + c(H+)=c(B-)+ c(OH-),c(Na+) -c(B-)=c(OH-)-c(H+)=9.9×10-7mol/L.错误。C.根据电荷守恒可得c(Na+) + c(H+)= c(OH-)+ 2c(CO32-)+ c(HCO3-);根据物料守恒可得c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)。代入第一个式子可得c(OH-)+c(CO32-)=c(H+)+c(H2CO3)。正确。D对于同种浓度的强碱弱酸盐,酸越强,盐水解的程度就越小,盐溶液的pH就越小。若同温下,pH相同时,则生成盐的酸的酸性越强,该酸产生的盐的浓度就越大。酸性:CH3COOH> H2CO3>C6H5OH> HCO3-.所以同温下,pH相同时,溶液物质的量浓度c(CH3COONa) >c(NaHCO3) >c(C6H5ONa) >c(Na2CO3)。错误。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾溶液加热 |
| B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl固体 |
| D.小苏打溶液中加入少量NaCl固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.W点所示的溶液中:c(Na+)+c(H+)=2c( )+c(OH-)+c(Cl-) )+c(OH-)+c(Cl-) |
B.pH=4的溶液中:c(H2CO3)+c(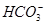 )+c( )+c( )<0.1 mol·L-1 )<0.1 mol·L-1 |
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(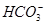 )=c(OH-)+c(Cl-) )=c(OH-)+c(Cl-) |
D.pH=11的溶液中:c(Na+)>c(Cl-)>c( )>c( )>c(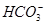 )>c(H2CO3) )>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )| A.加入MgCl2溶液 | B.加入少量NaOH |
| C.加入NH4NO3溶液 | D.加入K2S溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若NaHA溶液呈酸性,则H2A一定是强酸 |
| B.若NaHA溶液呈碱性,则H2A一定是弱酸 |
| C.NaHA溶液中Na+和HA-的个数之比一定大于1∶1 |
| D.NaHA晶体中的阴阳离子个数比一定是1∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com