
| A、1:1:1 |
| B、2:2:1 |
| C、2:3::1 |
| D、4:3:2 |
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、加压(体积变小),将使正逆反应速率均加快 |
| B、保持体积不变,加入少许NO2,将使正反应速率减小 |
| C、保持体积不变,加入少许N2O4,再达平衡时,颜色变深 |
| D、保持体积不变,升高温度,再达平衡时,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
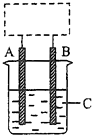 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+2HCl=H2↑+CuCl2,请回答:
某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+2HCl=H2↑+CuCl2,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150ml 1mol?L-1NaCl溶液 |
| B、75ml 2mol?L-1 KClO3溶液 |
| C、150ml 2mol?L-1 KCl溶液 |
| D、75ml 1mol?L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18g/mol |
| B、OH-的摩尔质量为17g |
| C、3.01×1023个SO2分子的质量为32g |
| D、标准状况下,1 mol任何物质的体积均约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与FeCl3溶液反应:Fe+Fe3+═2 Fe2+ |
| B、小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O |
| C、金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO2-+2H2↑ |
| D、钠与水的反应 2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10(2b-a)mol/L |
| B、10(b-a)mol/L |
| C、10(2a-b)mol/L |
| D、10(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
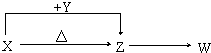 X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):
X、Y、Z、W四种常见化合物,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com