
| A. | 密闭容器中二氧化碳的体积分数不变 | |
| B. | 密闭容器中气体的总物质的量改变 | |
| C. | 密闭容器中混合气体的密度不变 | |
| D. | 2v(NH3)正=v(CO2)逆 |
分析 可逆反应NH2COONH4(s)?2NH3(g)+CO2(g)为气体体积增大的可逆反应,当该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断.
解答 解:A.该反应中,二氧化碳的体积分数始终不变,不能根据二氧化碳的体积分数判断平衡状态,故A错误;
B.该反应为气体体积缩小的反应,密闭容器中气体的总物质的量改变,说明该反应没有达到平衡状态,故B错误;
C.该反应前后气体的总质量不相等,而容器的容积不变,当密闭容器中混合气体的密度不变时,说明该反应达到平衡状态,故C正确;
D. 2v(NH3)正=v(CO2)逆,表示的是正逆反应,但是不满足化学计量数关系,说明该反应没有达到平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,A为易错点,注意该反应中二氧化碳的体积分数始终不变,试题培养了学生的灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
 、
、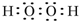 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ①浓氨水和固体NaOH制NH3
①浓氨水和固体NaOH制NH3 | A. | ②③ | B. | ①⑥⑦ | C. | ②⑤⑧ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H18O4 | B. | C14H16O4 | C. | C14H22O5 | D. | C14H20O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
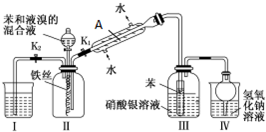
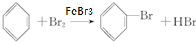
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和浓硫酸在加热的条件下可以反应,体现浓硫酸的强氧化性和酸性 | |
| B. | 将SO2通入盛有品红溶液的试管中红色褪去,给试管加热无明显变化 | |
| C. | 将干燥的Cl2通入装有红色鲜花的试管中,红花褪色,说明Cl2具有漂白性 | |
| D. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,会产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com