
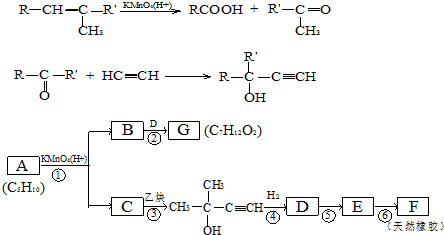
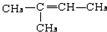 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2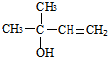 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$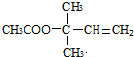 +H2O;
+H2O; .
.分析 C与乙炔发生信息中的加成反应生成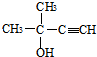 ,故C为
,故C为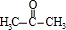 .A发生信息中的氧化反应生成C与B,A中含有C=C双键,结合C的结构与反应信息可知,A为CH3CH=C(CH3)2,故B为CH3COOH.
.A发生信息中的氧化反应生成C与B,A中含有C=C双键,结合C的结构与反应信息可知,A为CH3CH=C(CH3)2,故B为CH3COOH. 与氢气发生加成反应生成D,D转化为E,E转化为天然橡胶F,故E为CH2=C(CH3)-CH=CH2,故D为
与氢气发生加成反应生成D,D转化为E,E转化为天然橡胶F,故E为CH2=C(CH3)-CH=CH2,故D为 ,B与D发生酯化反应生成G,由G的分子式C7H12O2,G为
,B与D发生酯化反应生成G,由G的分子式C7H12O2,G为 ,再结合题目分析解答.
,再结合题目分析解答.
解答 解:C与乙炔发生信息中的加成反应生成 ,故C为
,故C为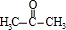 .A发生信息中的氧化反应生成C与B,A中含有C=C双键,结合C的结构与反应信息可知,A为CH3CH=C(CH3)2,故B为CH3COOH.
.A发生信息中的氧化反应生成C与B,A中含有C=C双键,结合C的结构与反应信息可知,A为CH3CH=C(CH3)2,故B为CH3COOH. 与氢气发生加成反应生成D,D转化为E,E转化为天然橡胶F,故E为CH2=C(CH3)-CH=CH2,故D为
与氢气发生加成反应生成D,D转化为E,E转化为天然橡胶F,故E为CH2=C(CH3)-CH=CH2,故D为 ,B与D发生酯化反应生成G,由G的分子式C7H12O2,G为
,B与D发生酯化反应生成G,由G的分子式C7H12O2,G为 ,
,
(1)题给以上分析知,A、C、E分别为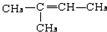 、CH3COCH3、CH2=C(CH3)CH=CH2,
、CH3COCH3、CH2=C(CH3)CH=CH2,
故答案为: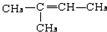 ;CH3COCH3;CH2=C(CH3)CH=CH2;
;CH3COCH3;CH2=C(CH3)CH=CH2;
(2)②是取代反应,⑤是消去反应,⑥是加聚反应,
故答案为:取代反应;消去反应;加聚反应;
(3)B→G分液方程式为CH3COOH+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,
E→F反应方程式为 ,
,
故答案为:CH3COOH+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O; ;
;
(4)E为CH2=C(CH3)-CH=CH2,E的链状同分异构体(不含E,由于C=C=C结构不稳定,不予考虑)有CH2=CHCH=CHCH3、CH2=CHCH2CH=CH2、CH≡CCH2CH2CH3、CH≡CCH(CH3)2、CH3C≡CCH2CH3,所以有五种,
故答案为:5.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,以B为突破口结合题给信息、反应条件进行推断,正确推断各物质结构简式是解本题关键,难点是(4)题同分异构体种类判断,要考虑官能团异构,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256 g S8分子中含S-S键为7NA个. | |
| C. | 由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气跟烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| B. | 漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 将氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ | |
| B. | 四种铈的核素${\;}_{58}^{136}$Ce、${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce,它们互为同位素 | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ | |
| D. | 金属铈应储存于阴凉、通风的地方,包装要密封,不可与空气接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | NO2 | D. | N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com