
 .
.
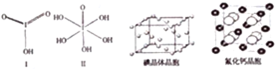
分析 I.(1)根据结构简式书写分子式;发生分解反应,生成两种单质和两种化合物,根据组成元素可知生成氮气和碳、水和CO;
(2)元素的非金属性越强,其电负性越强;根据C的价层电子对数判断;氮原子的价电子数为5,结合排布规律分析;
II.(1)石墨中层与层之间存在范德华力,六元环中存在离域π键;
(2)白石墨中每个六元环上含有3个B和3个N,每个每个原子被三个六元环共用;
(3)氮元素的电负性较大,吸引电子能力强,π键上的电子不能自由移动;
III.SiC是原子晶体,其结构类似金刚石,每个Si原子连接4个C原子,形成四面体结构;利用均摊法求出立方体中C、Si原子数,再根据ρ=$\frac{m}{V}$和V=(边长)3计算.
解答 解:I.(1)根据结构简式书写分子式为:C6H2O2N10,C6H2O2N10发生分解反应,生成两种单质和两种化合物,根据组成元素可知生成氮气和碳、水和CO,其反应的方程式为:C6H2N10O2=H2O↑+CO↑+5N2↑+5C;
故答案为:C6H2O2N10;C6H2N10O2=H2O↑+CO↑+5N2↑+5C;
(2)元素的非金属性越强,其电负性越强,则电负性:O>N>C>H;分子中C形成2个单键和一个双键,则C原子的价层电子对数为3,属于sp2杂化;氮原子的价电子数为5,其价电子排布图为 ;
;
故答案为:O>N>C>H;sp2; ;
;
II.(1)石墨中层与层之间存在范德华力,范德华力较弱,容易断裂,所以层与层之间可以自由滑动,即范德华力可以解释石墨的滑腻感,六元环中存在离域π键,离域π键的电子能自由流动,所以能导电;
故答案为:范德华力;离域π键;
(2)白石墨中每个六元环上含有3个B和3个N,每个每个原子被三个六元环共用,则平均每个六元环上含有1个B和1个N,则白石墨的化学式为(BN)n,
故答案为:(BN)n;
(3)氮元素的电负性较大,吸引电子能力强,π键上的电子在很大程度上被定域在氮的周围,不能自由流动,故(BN)n不导电,
故答案为:因为氮的电负性较大,π键上的电子在很大程度上被定域在氮的周围,不能自由流动,故(BN)n不导电;
III.SiC是原子晶体,其结构类似金刚石,每个Si原子连接4个C原子,形成四面体结构,则四个C原子在不同的两个面的不同顶点上,如图所示: ,
,
SiC中C与Si的原子个数比为1:1,设立方体的边长为r,则r2+r2+r2=(2a)2,则r=$\frac{2\sqrt{3}}{3}$a,
ρ=$\frac{m}{V}$=$\frac{\frac{(28+12)×\frac{1}{2}}{{N}_{A}}}{({\frac{2\sqrt{3}}{3}a)}^{3}}$=$\frac{15\sqrt{3}}{2{N}_{A}{a}^{3}}$g/cm3;
故答案为: ;$\frac{15\sqrt{3}}{2{N}_{A}{a}^{3}}$.
;$\frac{15\sqrt{3}}{2{N}_{A}{a}^{3}}$.
点评 本题考查了晶体类型和化学键的判断、杂化方式的判断、电子排布式的书写、电负性、第一电离能、微粒的空间结构、配位键、晶胞的计算等;考查的知识点较多,题目难度中等,注意对题中所给结构图的分析是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
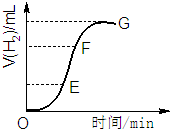 用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:
用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、淀粉均属于高分子化合物 | |
| B. | 浓硝酸沾到皮肤上能使皮肤变黄,这是由于浓硝酸和蛋白质发生了颜色反应 | |
| C. | 糖类、油脂、蛋白质都只由C、H、O三种元素组成的 | |
| D. | 利用油脂在碱性条件下的水解,可以制得肥皂和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是( )
氢氧燃料电池是一种将化学能转化为电能的高效、环境友好的发电装置.该电池的构造如图所示,下列分析判断错误的是( )| A. | a极为负极,b极为正极 | |
| B. | 负极发生氧化反应 | |
| C. | 正极的电极反应为O2+2H2O+2e-═4OH- | |
| D. | 负极的电极反应为H2+2OH--2e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
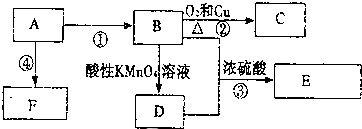
 ,F的结构简式
,F的结构简式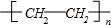 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com