
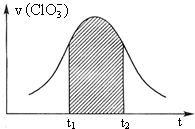
 KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )
KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )| A. | 开始时反应速率增大可能是由c(H+)增大所致 | |
| B. | 纵座标为v(H+)的v-t曲线与右图曲线完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 阴影部分面积可以表示t1-t2时间内c(Cl-)增加 |
分析 A.由题目信息可知反应的速率随c(H+)的增大而加快;
B.先根据电子得失守恒和原子守恒配平方程式,然后根据速率之比等于化学计量数之比;
C.根据随着反应的进行,反应物的浓度减少,反应速率减小;
D.先根据电子得失守恒和原子守恒配平方程式,然后根据改变的物质的量之比等于化学计量数之比.
解答 解:A.由方程式:ClO3-+HSO3--SO42-+Cl-+H+可知:反应开始时随着反应的进行,c(H+)不断增大,反应的速率加快由题目信息可知反应的速率随c(H+)的增大而加快,故A正确;
B.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,v(ClO3-):v(H+)=1:3,纵坐标为v(H+)的v-t曲线与图中曲线不重合,故B错误;
C.随着反应的进行,反应物的浓度减少,反应速率减小,所以后期反应速率下降的主要原因是反应物浓度减小,故C正确;
D.在反应中ClO3-+HSO3--SO42-+Cl-+H+,1molClO3-参加氧化还原反应得到6mol电子,1mol亚硫酸氢根离子参加氧化还原反应失去2mol电子,所以得失电子的最小公倍数是6,则ClO3-的计量数是1,亚硫酸氢根离子的计量数是3,其它原子根据原子守恒来配平,所以该方程式为:ClO3-+3HSO3-=3SO42-+Cl-+3H+,△n(Cl-):△n(ClO3-)=1:1,所以图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加,故D正确;
故选:B.
点评 本题考查化学反应速率的因素,为高考高频考点,侧重于学生的分析能力和基础知识的考查,有利于化学科学素养的培养和提高学生学习的积极性,难度不大,注意外界条件对反应速率的影响原因的理解.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O互称同位素 | B. | 氘(D)原子核外有1个电子 | ||
| C. | H与 D中子数不同 | D. | H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加 | |
| B. | 设NA为阿伏加德罗常数的值,500 mL 1mol/L氯化铁溶液中Fe3+的数目等于0.5NA | |
| C. | 常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12 | |
| D. | 要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com