
| A. | ②>①>④>③ | B. | ①=②=③=④ | C. | ②=③>①=④ | D. | ②<①<③<④ |
分析 酸或碱抑制水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,根据c(H+)水=c(OH-)水,结合Kw的公式计算.
解答 解:酸或碱抑制水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,
①0.01mol•L-1 的盐酸中c(H+)=0.01mol•L-1,c(H+)水=c(OH-)水=$\frac{{K}_{W}}{C({H}^{+})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L;
②pH=2的醋酸中c(H+)=0.01mol•L-1,c(H+)水=c(OH-)水=$\frac{{K}_{W}}{C({H}^{+})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L;
③pH=12的氨水中c(OH-)=0.01mol•L-1,c(H+)水=$\frac{{K}_{W}}{C(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L;
④0.01mol•L-1 的NaOH溶液中c(OH-)=0.01mol•L-1,c(H+)水=$\frac{{K}_{W}}{C(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L=10-12mol/L;
则由水电离出的c(H+)大小关系①=②=③=④,
故选B.
点评 本题考查溶液中水电离的氢离子浓度的计算,注意把握酸或碱如何影响水电离、以及溶液中氢离子浓度的计算方法是解本题关键,酸中水电离出的c(H+)和碱中水电离出的c(OH-)的计算是学习难点,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 min时,M的转化率为80% | |
| B. | 4 min时,用M表示的反应速率为0.8 mol•L-1•min-1 | |
| C. | 4 min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 | |
| D. | 2 min时,M的物质的量浓度为0.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铁弱,可以用铜罐代替铁罐盛装和运输浓硝酸 | |
| B. | 明矾净水与铁粉作食品的脱氧剂都利用了物质的还原性 | |
| C. | 钢瓶可以运输液氯 | |
| D. | 用氧化铝制成的耐高温坩埚可以用于熔融氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尽管NO2能与水反应生成硝酸,但NO2不属于酸性氧化物 | |
| B. | Na2O2粉末加入到FeSO4溶液中,产生白色沉淀,并放出大量气泡 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 往酸性KMnO4溶液中通入SO2验证SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
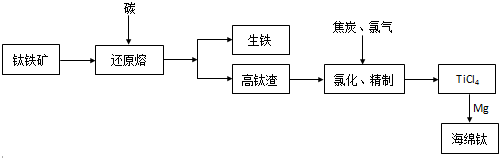
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 HSO3-+OH-
HSO3-+OH-| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置. | |
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的酸性高锰酸钾溶液. | 若溶液褪色,说明其有Na2SO3 若溶液不褪色,说明其中没有Na2SO3 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加氯化钡溶液. | 如果有白色沉淀生成,则说明其中有Na2SO4,已经变质. 如果没有白色沉淀生成,则说明其中没有Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com