
| A、80g硝酸铵中含有氮原子数为NA |
| B、0.lmolN5+离子中所含的电子数为3.4NA |
| C、1mol甲烷和NA个甲烷分子的质量相等 |
| D、16g氧气和16g臭氧所含的原子数均为NA |
| m |
| M |
| m |
| M |
| m |
| M |
| 80g |
| 80g/mol |
| m |
| M |
| 16g |
| 32g/mol |
| m |
| M |
| 16g |
| 48g/mol |
| 1 |
| 3 |
| 1 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、容器内气体颜色变深,平均相对分子质量不变 |
| B、平衡不移动,混合气体密度增大 |
| C、H2转化率增大,HI平衡浓度变小 |
D、 改变条件前后,速率图象为(如图) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某烷烃命名为2,3,4-三甲基-3,5-二乙基己烷 |
B、结构片段为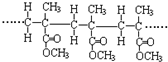 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 |
C、等物质的量的Na、NaOH、NaHCO3分别与足量的有机物 (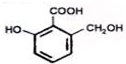 )充分反应,消耗该有机物的物质的量之比为3:2:1 )充分反应,消耗该有机物的物质的量之比为3:2:1 |
D、化合物 在酸性条件下加热水解,所得溶液加碱后加热有NH3生成 在酸性条件下加热水解,所得溶液加碱后加热有NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性 Rb>K>Mg>Al |
| B、非金属性 As>S>Cl>F |
| C、稳定性 AsH3>PH3>H2S>HF |
| D、半径 Na>P>O>F |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第1份 | 第2分 | |
| 混合物质量(g) | 9.2 | 20.8 |
| 反应后固体质量(g) | 8.3 | 15.9 |
| A、第二份得到的反应后固体是纯净物 |
| B、第1份混合物中NaOH的质量分数更大 |
| C、根据表中数据不能计算出第1份混合物中NaHCO3的质量分数 |
| D、第2份混合物中NaOH的物质的量小于NaHCO3的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油裂化可获得乙烯、丙烯和丁二烯 |
| B、石油裂解的目的主要是为了得到更多的汽油 |
| C、盐析可用于提纯蛋白质并保持其生理活性 |
| D、木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2:可表示一个氧气分子中有2个氧原子 |
| B、2C:可表示两个碳原子 |
| C、S2-:可表示一个硫离子带2个单位负电荷 |
| D、NH3:可判断出该物质中N、H元素的个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①②③④⑥ |
| C、只有①②③ | D、只有②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com