
| A. | CH4+C12$\stackrel{光}{→}$CH3Cl+HCl | B. | CH2=CH2+C12→ | ||
| C. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ +HBr +HBr | D. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
常见能发生加成反应的物质往往含有C=C、C≡C、C=O等官能团,以此解答该题.
解答 解;A.甲烷与氯气反应,甲烷中的氢原子被氯原子所代替生成氯代物,属于取代反应,故A错误;
B.乙烯含有碳碳双键,可与氯气发生加成反应1,2-二氯乙烷,故B正确;
C.苯中的氢原子被溴原子所取代,属于取代反应,故C错误;
D.甲烷的燃烧为氧化还原反应,故D错误;
故选B.
点评 本题主要考查了加成反应的判断,加成反应的条件是有机物中必须含有不饱和键(如碳碳双键、碳碳三键等).


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 |
| 步骤 | 滴加3~10滴浓硫酸 | 滴加10~20滴6mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2发生氧化反应,HCl发生还原反应 | |
| B. | 每反应掉4mol HCl转移2 mol电子 | |
| C. | 每生成1mol Cl2转移4 mol电子 | |
| D. | 反应中锰元素将电子转移给氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是电解质的可能性大 | B. | X不可能是非电解质 | ||
| C. | X只能是盐类 | D. | X可以是任意化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
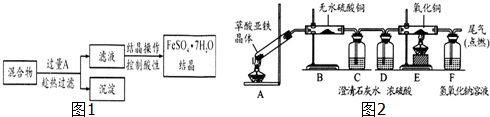
 Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核能和地热能来自地球自身 | |
| B. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| C. | 动物体内葡萄糖被氧化成CO2是热能转化成化学能 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转化成化学能的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com