
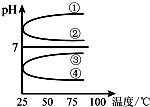
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:分析 五种物质中NaOH、NH3•H2O显碱性,CH3COOH、HCl、NH4HSO4均显酸性,A的溶液呈酸性,能与B、D反应,则A为的CH3COOH、HCl、NH4HSO4中的一种,B、D分别为NaOH、NH3•H2O中的一种.A等量的B或D反应呈中性时消耗B溶液体积小于D溶液体积,则D为NaOH、B为NH3•H2O.浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,则C为NH4HSO4;浓度均为0.1mol•L-1A和E溶液,pH:A<E,则A为HCl,E为CH3COOH.
解答 解:(1)五种物质中NaOH、NH3•H2O显碱性,CH3COOH、HCl、NH4HSO4均显酸性,A的溶液呈酸性,能与B、D反应,则A为的CH3COOH、HCl、NH4HSO4中的一种,B、D分别为NaOH、NH3•H2O中的一种.A等量的B或D反应呈中性时消耗B溶液体积小于D溶液体积,则D为NaOH、B为NH3•H2O.浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,则C为NH4HSO4;浓度均为0.1mol•L-1A和E溶液,pH:A<E,则A为HCl,E为CH3COOH,
故答案为:NaOH;
(2)①.B溶液为氨水溶液,由NH3•H2O?OH-+NH4+可知,加水促进电离,则n(NH3•H2O)减少,n(OH-)增大,则$\frac{c(B)}{c(O{H}^{-})}$=$\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$减小,故①正确;
②.由NH3•H2O?OH-+NH4+可知,加水促进电离,则n(NH3•H2O)减少,n(OH-)增大,c(NH3•H2O)、c(OH-)都减小,c(H+)减小,则$\frac{c(O{H}^{-})}{c({H}^{+})}$减小,故②正确;
③.因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④.由NH3•H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)c(OH-)和体积均相等的两份溶液A和E,A为HCl,E为CH3COOH,醋酸是弱电解质存在电离平衡,所以醋酸溶液浓度大于盐酸浓度,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,则HCl反应后剩余锌.
①随反应进行氢离子浓度减小,但醋酸会继续电离出氢离子,反应速率较快,反应所需要的时间醋酸短:E<A,故①错误;
②开始氢离子浓度相同,反应时的速率相同:A=E,故②错误;
③生成氢气相同,结合电子守恒,参加反应的锌粉的物质的量:A=E,故③正确;
④反应过程的平均速率,醋酸大于盐酸:E>A,故④正确;
⑤最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同,只有强酸盐酸反应后剩余锌,A溶液中有锌粉剩余,故⑤错误,
故答案为:③④;
(4)等体积、等物质的量浓度B和C混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,PH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,PH减小,③错误、④正确,
故答案为:④;
(5)常温下,向0.01mol/L C(NH4HSO4)溶液中滴加0.01mol/L D(NaOH)溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3•H2O更难电离).当加入等物质的量的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+);
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查无机物推断、弱电解质电离、盐类水解、离子浓度大小比较等,关键是推断物质,水对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 1:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2>CsCl>CBr4>CF4 | B. | CF4>CCl4>CBr4>Cl4 | ||
| C. | 金刚石>晶体硅>二氧化硅>碳化硅 | D. | NaF>MgF2>AlF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA | |
| B. | 1.5 mol NO2与足量水反应,转移的电子数为1.5 NA | |
| C. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| D. | 常温常压下,11.2 L Cl2含氯原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com