
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
(1)Ⅰ、已知反应N2O4(g)2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.下列说法能说明透光率不再发生改变的有 . a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
(2)Ⅱ、用NH3催化还原NOx可以消除氮氧化物的污染.下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g).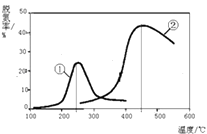
a.该反应的△S0(填“>”、“=”或“<”).
b.以下说法正确的是 .
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(3)Ⅲ、用CH4催化还原NOx也可以消除氮氧化物的污染.a.已知:CH4(g)的标准燃烧热为﹣890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=﹣114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式: .
b.在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)= .
②T1T2(填“>”或“<”,下空同);判断理由是 .
③T1℃时,反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)平衡常数K= .
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 达新平衡时CH4的转化率将(填“增大”、“减小”或“不变”).
【答案】
(1)ad
(2)>;C
(3)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣844kJ/mol;0.0125mol/(L.s);<;升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应;6.4;减小
【解析】解:Ⅰ.透光率不再发生改变,说明二氧化氮的浓度不变,反应到达平衡,a.气体颜色不再改变,说明二氧化氮浓度不变,透光率不再发生改变,故a正确;b.焓变△H与是否到达平衡无关,与物质的聚集状态与化学计量数有关,故b错误;c.应是2v正(N2O4)=v逆(NO2)时,反应到达平衡,二氧化氮的浓度不变,故c错误;d.N2O4的转化率不再改变,反应到达平衡,二氧化氮的浓度不变,透光率不再发生改变,故d正确,故答案为:ad;
Ⅱ.a.反应前气体的化学计量数为4,反应后计量数之和为5,正反应是混乱度增加的反应,所以△S>0;故答案为:>;b.A.催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误;B.该反应为体积增大的反应,增大压强,平衡向着逆向移动,所以压强对脱氮率有影响,故B错误;C.由图象可知,催化剂①、②分别适合于250℃和450℃左右脱氮,其催化活性最好,故C正确;故答案为:C;
Ⅲ.a.CH4(g)的标准燃烧热为﹣890kJ/mol,热化学方程式:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量,反应的热化学方程式:②H2O(l)=H2O(g)△H=44KJ/mol,③CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1114kJ/mol④2NO(g)+O2(g)═2NO2(g)△H=﹣114kJ/mol
依据盖斯定律计算①+②×2+③﹣④×2CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣844kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣844kJ/mol;
b.①温度为T1℃时,0~20min内v(NO2)= ![]() =0.025mol/(L.s),速率之比等于化学计量数之比,则v(CH4)=
=0.025mol/(L.s),速率之比等于化学计量数之比,则v(CH4)= ![]() v(NO2)=0.0125mol/(L.s),
v(NO2)=0.0125mol/(L.s),
故答案为:0.0125mol/(L.s);②由表中数据可知,T2温度反应速率较快,温度越高,反应速率越快,故温度T1<T2 , 温度T2先到达平衡,而升高温度,NO2的物质的量增大,说明平衡逆向移动,故正反应为放热反应,则△H<0,故答案为:<;升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应;
③温度为T1℃时,40min到达平衡,平衡时二氧化氮物质的量为0.4mol,则:
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)
起始量(mol):0.5 1.2 0 0 0
变化量(mol):0.4 0.8 0.4 0.4 0.8
平衡量(mol):0.1 0.4 0.4 0.4 0.8
容器的体积为1L,则平衡常数K= ![]() =
= ![]() =6.4,
=6.4,
故答案为:6.4;④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 等效在原平衡基础上增大压强,平衡逆向移动,达新平衡时CH4的转化率将减小,
故答案为:减小.
Ⅰ.透光率不再发生改变,说明二氧化氮的浓度不变,反应到达平衡;Ⅱ.a.熵是用描述混乱程度的,△S就是混乱程度的变化,根据反应前后气体体积变化判断熵变;b.A、催化剂只影响反应速率,不会改变转化率;B、根据反应原理可知,正反应是体积增大的反应,压强影响脱氮率;C、根据图象数据可知,催化剂①、②发挥增大催化效果的温度分别为250℃和450℃;
Ⅲ.a.已知:CH4(g)的标准燃烧热为﹣890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.写出热化学方程式,结合盖斯定律计算得到所需热化学方程式;b.①根据v= ![]() 计算v(NO2),再利用速率之比等于化学计量数之比计算v(CH4);②由表中数据可知,T2温度反应速率较快,温度越高,反应速率越快,先到达平衡,而升高温度,NO2的物质的量增大,说明平衡逆向移动;③化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;温度为T1℃时,40min到达平衡,计算平衡时各组分浓度,代入平衡常数表达式计算;④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 等效在原平衡基础上增大压强,平衡逆向移动.
计算v(NO2),再利用速率之比等于化学计量数之比计算v(CH4);②由表中数据可知,T2温度反应速率较快,温度越高,反应速率越快,先到达平衡,而升高温度,NO2的物质的量增大,说明平衡逆向移动;③化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;温度为T1℃时,40min到达平衡,计算平衡时各组分浓度,代入平衡常数表达式计算;④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 等效在原平衡基础上增大压强,平衡逆向移动.


科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 用氯化铁溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+
B. Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-![]() =9Fe3++NO↑+14H2O
=9Fe3++NO↑+14H2O
C. 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
D. 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3+ + 2SO42- + 2Ba2+ + 4OH-== AlO2-+ 2BaSO4↓+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,13g某气体所含的分子数与14gCO 所含的分子数相等。此气体在标准状况下的密度为( )
A. 1.25g·L-1 B. 2.32 g·L-1 C. 1.65 g·L-1 D. 1.16 g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 标准状况下,22.4 L 14CO2与44 g 14CO2含分子数均为NA
B. 1 mol CH3COOH与足量CH3CH2OH在浓硫酸存在下共热生成NA个乙酸乙酯分子
C. 常温下,pH=13的NaOH溶液中含OH-离子数为0.1 NA
D. 浓度为2 mol/L的FeCl3溶液500 mL水解后生成Fe(OH)3胶体粒子数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一真空储气瓶质量为400g,在相同条件下,装满O2时质量为404克,装满另一种气体X时质量为405.5克,则X的相对分子质量为( )
A. 44 B. 64 C. 71 D. 48
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L
②若1 mol气体的体积为22.4 L,则它一定处于标准状况下
③标准状况下,1 LCO和1 L H2O的物质的量相同
④标准状况下,1 g H2和14 g N2的体积相同
⑤28 g CO的体积为22.4 L
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ④⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列4个有机化合物中,能够发生酯化、加成和氧化3种反应的是( ) ①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH ④CH3CH2CH2OH⑤ ![]()
A.①③④
B.②④
C.①③⑤
D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,没有颜色变化的是
A.葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热
B.淀粉溶液中加入碘酒
C.鸡蛋清中加入浓硝酸
D.淀粉溶液中加入稀硫酸并加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com