
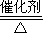
 4NO+6H2O,
4NO+6H2O,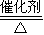 4NO+6H2O;
4NO+6H2O;

科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,;种是固体。请回答下列问题:
(1)B元素单质的电子式 ,F元素氧化物的晶体类型为 。
(2)由A、C两元素可组成X、Y两种化合物,X在MnO2作用下可以分解成Y,写出X转化为Y的化学方程式 。
(3)若E是非金属元素,但能表现出一些金属元素的性质。写出E与D的氧化物的水溶液反应的离子方程式 。
(4)一定条件下,A的单质与B的单质充分反应生成6.8gW气体时,可放出18.48kJ热量,写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图 ;
F元素氧化物的晶体类型为 。
(2)比较B、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式: ,该阳离
子中存在的化学键有 ,并写出该阳离子与F氢化物的水溶
液反应的离子方程式: 。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三下学期阶段检测化学试卷 题型:填空题
现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,;种是固体。请回答下列问题:
(1)B元素单质的电子式 ,F元素氧化物的晶体类型为 。
(2)由A、C两元素可组成X、Y两种化合物,X在MnO2作用下可以分解成Y,写出X转化为Y的化学方程式 。
(3)若E是非金属元素,但能表现出一些金属元素的性质。写出E与D的氧化物的水溶液反应的离子方程式 。
(4)一定条件下,A的单质与B的单质充分反应生成6.8gW气体时,可放出18.48kJ热量,写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省东阳市高三下学期期中考试化学试卷 题型:填空题
16分)现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半。又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体。请回答下列问题:
(1)D离子的结构示意图 ;
F元素氧化物的晶体类型为 。
(2)比较B、C、D元素简单离子半径的大小: > > (填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因: ;
用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较
强的氧化性的阳离子,试写出阳离子的电子式: ,该阳离
子中存在的化学键有 ,并写出该阳离子与F氢化物的水溶
液反应的离子方程式: 。
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应,E的最高价氧化物的水化物难溶于水,已知298K时,该难溶物质的的KSP=5.6×10-12,若此时测得溶液pH
=13.00,则此温度下残留在溶液中的E离子物质的量浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com