
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;NaHCO3溶液与硝酸溶液
D.石灰石与硝酸;石灰石与盐酸
科目:高中化学 来源: 题型:
(1)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。理论上硫酸和硝酸的物质的量之比最佳为:
_________________________________。
(2)实际上,即使铜粉、硫酸及硝酸都比较纯,制得的CuSO4·5H2O中还是有可能存在的杂质是________,除去这种杂质的实验操作称为_____________________________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉在________(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
请回答下列问题:已知:Ksp[Cu(OH)2]≈10- 22,Ksp[Fe(OH)2]≈10-16,Ksp[Fe(OH)3]≈10-38
22,Ksp[Fe(OH)2]≈10-16,Ksp[Fe(OH)3]≈10-38
①为了使铁元素全部沉淀,应调节pH至少为______________________________;
②甲物质可选用的是________;
A.CuCl2 B.NaOH C.Cu2(OH)2CO3 D.CuO E.H2SO4
③反应中加入少量FeSO4对铜的氧化可以起催化作用。其反应过程是:第1步,4Fe2++O2+4H+===4Fe3++2H2O,请写出其第2歩反应的离子方程式_____________________
________________________________________________________________________。
方案丙:将铜丝放到一定量的稀硫酸中,加入适量的H2O2,并控温在50 ℃~60 ℃,持续反应1 h,也能获得硫酸铜。请回答下列问题:
④反应时温度必须控制在50 ℃~60 ℃,温度不宜过高的主要原因是
________________________________________________________________________;
⑤写出该反应的化学方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应不属于氧化还原反应的是( )
A.2F2+2H2O===4HF+O2 B.3CO+Fe2O3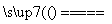 2Fe+3CO2
2Fe+3CO2
C.AgNO3+NaCl===AgCl↓+NaNO3 D.MgCl2(熔融)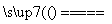 Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于容量瓶及其使用方法的叙述,正确的是( )
①是配制一定物质的量浓度的溶液的专用仪器 ②使用前要先检查容量瓶是否漏液 ③容量瓶可以用来加热 ④不能用容量瓶贮存配制好的溶液 ⑤可以用500 mL容量瓶配制250 mL溶液
A.①③ B.①②④ C.除了③ D.除了⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
用AgNO3溶液和NaCl、MgCl2、AlCl3三种溶液分别反应时,(1)若把同体积、同物质的量浓度的三种溶液中的Cl-全部沉淀下来,所需AgNO3溶液的体积比是________;
(2)若把同体积的三种溶液中的Cl-全部沉淀下来,所用AgNO3溶液体积相同,则此三种溶液中溶质的物质的量浓度之比为______________,生成沉淀的质量比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于两种物质的说法正确的是
( )。
A.炒菜时放入食盐并不破坏NaCl中的化学键
B.HCl的电子式是H+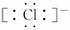
C.NaCl熔化时破坏共价键
D.HCl的结构式是H—Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
最近,国际上提出的“绿色化学”是指化学工业生产中
( )。
A.对废水、废气、废渣进行严格处理
B.化学生产中不排放任何有害物质
C.化工厂及周围种草、种树、种花,使工厂成为花园式工厂
D.以绿色植物为原料,以生物催化剂实现化工生产过程的化学
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
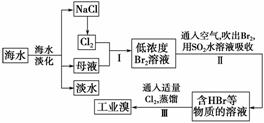
(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com