



 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
A、 | |||
B、CH3CH2CH2CHOHCH3
| |||
C、2CH3CH2OH
| |||
D、CH3COOH+CH3OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 ②
② ③
③ ④
④ ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH| A、能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩ |
| B、投入钠能产生H2的是⑤⑦⑧⑨ |
| C、属于高分子材料的是⑧⑨⑩ |
| D、含碳量最高、有毒、常温下为液体且点燃时有浓烟的是① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、NiO(OH) |
| B、Ni(OH)2 |
| C、H2 |
| D、H2和NiO(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
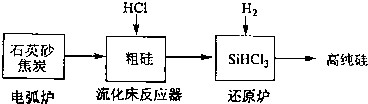
| 发生的主要反应 | |||||
| 电弧炉 | SiO2+2C
| ||||
| 流化床反器 | Si+3HCl
| ||||
| 还原炉 | SiHCl3+H2
|
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
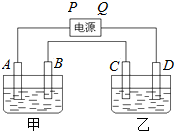 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质失电子的反应为还原反应 |
| B、物质在变化中得到电子,此物质是还原剂 |
| C、发生电子转移的反应即是氧化还原反应 |
| D、发生化合价升降的反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com