
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况.
| 步骤 | 操作 | 现象 |
| I | 向2mL 1mol•L﹣1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH 7(填“<”、“>”或“=”).
(2)分析红褐色产生的原因.
①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因: .
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
□Fe3++□SO32﹣+□ ═□Fe2+□ +□
乙同学查阅资料得知:
| 1.Fe2+与SO32﹣反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色. |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3.而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是 .
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1mol•L﹣1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是 (填字母).
a.K3[Fe(CN)6]溶液 b.KSCN溶液 c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因: .
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确.
| 性质实验方案的设计.. | |
| 专题: | 实验设计题. |
| 分析: | (1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性; (2)①步骤I中溶液呈红褐色的原因是:Fe3++3H2O═Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3; ②Fe3+→Fe2+,化合价从+3→+2,降低1价,SO32﹣→SO42﹣,化合价从+4→+6,升高2价,根据化合价升高和降低总数相等以及原子守恒配平得方程式2Fe3++SO32﹣+H2O═2Fe2++SO42﹣+2H+; (3)根据乙同学查阅资料得知:1.Fe2+与SO32﹣反应生成墨绿色的絮状沉淀FeSO3;2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色,故而乙同学认为甲同学得出结论的证据仍然不足,由是 FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”; (4)①a.K3[Fe(CN)6]溶液与Fe2+ 会产生蓝色沉淀; b.KSCN溶液用于检验Fe3+; c.溶液中的二氧化硫会干扰KMnO4溶液检验Fe2+; ②步骤III中出现红褐色的原因:H2SO3⇌H++HSO3﹣;HSO3﹣⇌H++SO32﹣,SO32﹣与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色. |
| 解答: | 解:(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O⇌Fe(OH)3+2H+,所以其溶液pH<7,故答案为:<; (2)①甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,原因是:Fe3++3H2O⇌Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3,故答案为:Fe3++3H2O⇌Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3; ②Fe3+→Fe2+,化合价从+3→+2,降低1价,SO32﹣→SO42﹣,化合价从+4→+6,升高2价,根据化合价升高和降低总数相等以及原子守恒配平得方程式2Fe3++SO32﹣+H2O═2Fe2++SO42﹣+2H+,故答案为:2Fe3++SO32﹣+H2O═2Fe2++SO42﹣+2H+; (3)根据乙同学查阅资料得知:1.Fe2+与SO32﹣反应生成墨绿色的絮状沉淀FeSO3;2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色,故而乙同学认为甲同学得出结论的证据仍然不足,理由是 FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”,故答案为:FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”; (4)①a.K3[Fe(CN)6]溶液与Fe2+ 会产生蓝色沉淀,故可用于检验步骤III中红褐色溶液是否含有Fe2+,故a正确; b.KSCN溶液用于检验Fe3+,故b错误; c.溶液中的二氧化硫会干扰KMnO4溶液检验Fe2+,故c错误; 故选a; ②步骤III中出现红褐色的原因:H2SO3⇌H++HSO3﹣、HSO3﹣⇌H++SO32﹣,SO32﹣与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色, 故答案为:H2SO3⇌H++HSO3﹣、HSO3﹣⇌H++SO32﹣,SO32﹣与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色. |
| 点评: | 本题考查了探究反应机理的方法,题目难度中等,本题充分考查了学生的分析、理解能力及灵活应用所学知识的能力. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(1)低血糖病症发作时,喝葡萄糖水可快速见效。葡萄糖作为营养剂供给人体能量,在体内发生的主要反应是________(填写字母)。
A.加成反应
B.取代反应
C.氧化反应
(2)下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
| 品名 | ××× |
| 配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、碳酸氢钠、柠檬酸、柠檬汁、食盐、甜蜜素、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 保质期 | 240天 |
| 生产日期 | 标于包装袋封口上 |
①富含油脂的是________________________________________________________;
②富含糖类的是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制500 mL 0.2 mol/L的碳酸钠溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取________g碳酸钠。
(2)称量的操作顺序为________(填选项字母)。
A.调天平零点 B.游码归零 C.向小烧杯中加碳酸钠 D.称量空烧杯 E.向右盘加砝码并将游码移到所需位置 F.将砝码归盒 G.记录称量结果
(3)若砝码和药品位置放颠倒(假设称量时未用烧杯),天平平衡时,实际称量碳酸钠的质量是________。
(4)下列操作使所配溶液浓度偏高的是________。
A.称取28.6 g Na2CO3·10H2O进行配制
B.称量时用了生锈的砝码
C.往容量瓶转移溶液时,有少量液体溅出
D.碳酸钠中含有不溶性杂质
E.未洗涤溶解Na2CO3的烧杯
F.定容时仰视刻度线
G.小烧杯洗净后未干燥即用来称量
H.容量瓶未干燥即用来配制溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 含有离子键和共价键的化合物一定是离子化合物 |
|
| B. | 11H2O.12H2O.13H2O互为同位素 |
|
| C. | 目前人们已发现的元素种类数目与原子种类数目相同 |
|
| D. | 多电子原子中,在离核较近的区域内运动的电子能量较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
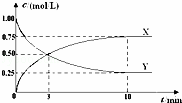
将CO2转化为甲醇的原理为 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0.500℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
|
| A. | 曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 |
|
| B. | 从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) |
|
| C. | 平衡时H2 的转化率为75% |
|
| D. | 500℃时该反应的平衡常数K=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性锌锰干电池是生活中应用最广泛的电池,下列说法中不正确的是( )
A.该电池正极反应式为:MnO2+H2O+e-===MnO(OH)+OH-
B.电池工作时负极pH一定降低
C.用该电池作电源精炼铜,纯铜与锌连接
D.用该电池作电源电解硫酸铜溶液,负极溶解6.5 g锌,阴极一定析出6.4 g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
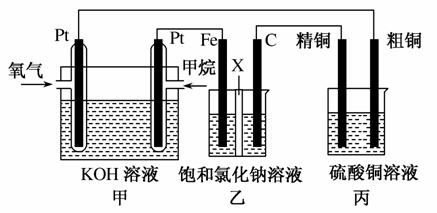
(1)甲烷燃料电池负极反应式是__________________。
(2)石墨(C)极的电极反应式为__________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L;丙装置中阴极析出铜的质量为________g。
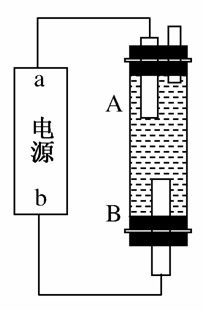
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用________。
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com