
| A. | 铅蓄电池属于二次电池,在充电过程中,阳极质量减小,阴极质量增加 | |
| B. | 常温下,能自发进行的反应,△H一定小于“0” | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的活化能 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
分析 A.铅蓄电池放电时,负极电极反应式为:Pb+SO42--2e-=PbSO4 ,正极电极反应式为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O,所以正负极质量都增加,充电与放电相反;
B.反应自发进行的判断依据是△H-T△S<0;
C.催化剂使化学反应速率加快的原因是降低了反应所需的活化能;
D.根据金属活动顺序表可知铜离子与锌离子的氧化性强弱,根据三价铁离子与铜的反应可判断三价铁与铜离子的氧化性强弱.
解答 解:A.铅蓄电池放电时,负极电极反应式为:Pb+SO42--2e-=PbSO4 ,正极电极反应式为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O,所以正负极质量都增加,充电与放电相反,阴极和阳极质量都减小,故A错误;
B.反应自发进行的判断依据是△H-T△S<0,在室温下能自发进行的反应,其△H不一定小于0,与△S有关,故B错误;
C.催化剂使化学反应速率加快的原因是降低了反应所需的活化能,使活化分子的百分数增加,故C错误;
D.金属活动顺序表中单质的还原性越强,对应的阳离子氧化性越弱,锌比铜活泼,则铜离子比锌离子的氧化性强,根据三价铁离子与铜的反应:2Fe3++Cu=2Fe2++Cu2+,由强制弱可判断三价铁氧化性比铜离子的氧化性强,即相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱,故D正确,
故选D.
点评 本题考查较为综合,涉及铅蓄电池、化学反应的方向、化学反应速率的影响以及氧化性的比较等,为高考常见题型,侧重于学生的分析能力和基础知识的综合理解和运用的考查,难度不大,注意金属活动顺序表中二价铁与三价铁的位置.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:实验题
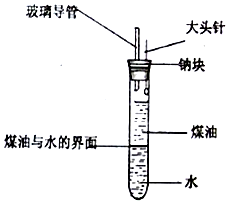 某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:
某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实脸并验证①钠的物理性质;②钠和水反应的产物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属发生腐蚀的实质是:M-ne-=Mn+ | |
| B. | 金属发生的电化学腐蚀比化学腐蚀要普遍得多 | |
| C. | 防止金属生锈可以通过涂油漆、镀金属等方法在其表面覆盖一层保护膜 | |
| D. | 在钢铁上连接一个铜块可以防止钢铁生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸 | B. | 碳酸钠溶液 | C. | CuSO4溶液 | D. | KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NOx被还原 | B. | CO是还原剂 | ||
| C. | NOx反应中得到电子 | D. | CO发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Si-O | O═O | Si-Si |
| 键能/kJ•mol-1 | x | 498.8 | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在:Al3+、NH4+、S2-、Cl- | |
| B. | 酸性溶液中可能大量存在:I-、ClO-、SO42-、Na+ | |
| C. | 中性溶液中可能大量存在:SO42-、K+、Fe3+、Cl- | |
| D. | 弱碱性溶液中可能大量存在:Na+、K+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com