
【题目】质谱图显示,某化合物的相对分子质量为74;燃烧实验发现,该化合物分子内碳、氢原子个数之比为2∶5;核磁共振氢谱显示,该化合物分子中只有两种类型的氢原子。下列关于该化合物的叙述不正确的是( )
A.该化合物可能为![]() 甲基
甲基![]() 丙醇B.该化合物为
丙醇B.该化合物为![]() 丁醇的同分异构体
丁醇的同分异构体
C.该化合物可能为乙醚D.该化合物为乙醚的同系物
科目:高中化学 来源: 题型:
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:

(1)已知:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g) ![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应I的热化学方程式__________________________________________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。
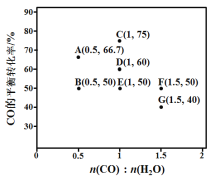
①经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=__________(填数值)。在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是_____
②对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是________
③比较A、B两点对应的反应速率大小:VA________VB(填“<” “=”或“>”)。反应速率v=v正v逆= K正X(CO)![]() X(H2O) –K逆X( CO2)
X(H2O) –K逆X( CO2)![]() X(H2),K正、K逆分别为反应速率常数,X为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
X(H2),K正、K逆分别为反应速率常数,X为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
![]() =__________ (计算结果保留1位小数)。
=__________ (计算结果保留1位小数)。
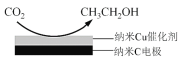
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中 =________(列出计算式)。
=________(列出计算式)。
②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变,0.1mol/L甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是( )
已知:δ(RCOOH)=![]()
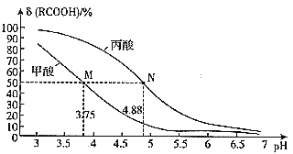
A.等浓度的HCOONa和CH3CH2COONa两种溶液中水的电离程度比较:前者>后者
B.将等浓度的HCOOH溶液与HCOONa溶液等体积混合,所得溶液中:c(HCOOH)+2c(H+)>c(OH-)+c(HCOO-)
C.图中M、N两点对应溶液中的Kw比较:前者>后者
D.1mol/L丙酸的电离常数K﹤10-4.88
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①、CH3—CH=CH2和CH2=CH2的最简式相同 ②、 CH≡CH和C6H6含碳量相同
③、丁二烯和丁烯为同系物 ④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤、标准状况下,11.2 L的庚烷所含的分子数为0. 5 NA(NA为阿伏加德罗常数)
⑥、能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法
A.①和⑤B.②和③C.③⑤和⑥D.④和⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料(M)。具体合成路线如图所示(部分反应条件略去):
是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料(M)。具体合成路线如图所示(部分反应条件略去):
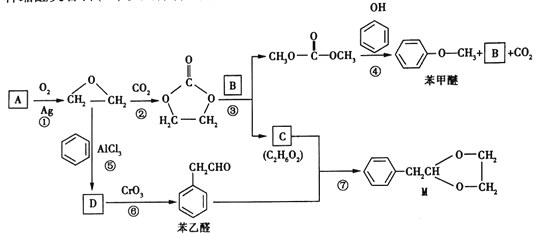
已知:①![]() 。
。
②D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子,D中氧元素的质量分数约为13.1%。试回答下列问题:
(1)A的名称是_______,图中缩醛(M)的分子式是______。
(2)B的结构简式为___________。
(3)⑤的化学方程式为_____________。
(4)⑥的反应类型是___________。
(5)请写出核磁共振氢谱有4组峰,且峰面积之比为3∶2∶2∶1,并含有苯环和![]() 结构的苯乙醛的所有同分异构体的结构简式:_____________。
结构的苯乙醛的所有同分异构体的结构简式:_____________。
(6)参照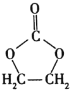 的合成路线,设计一条由
的合成路线,设计一条由![]() 氯丙烷和必要的无机试剂制备
氯丙烷和必要的无机试剂制备 的合成路线(注明必要的反应条件):_________________________。
的合成路线(注明必要的反应条件):_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)2NO2(g)△H,上述反应分两步完成,其反应历程如图1所示, 回答下列问题:
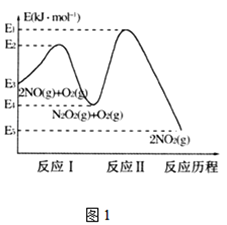
①写出反应I的热化学方程式________________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
2NO2(g)反应速率的是___(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是_____________(反应未使用催化剂)。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)![]() N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。
N2(g)+2CO2(g),起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。

①0~10min,1020 min,3040 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为_________,其值是___________________。
②计算反应达到第一次平衡时的平衡常数K=____________。
③第10min时,若只改变了影响反应的一个条件,则改变的条件为______(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。
N2O4(g)△H<0,在图3标出点中,指出能表示反应达到平衡状态的点是________,理由是________________。
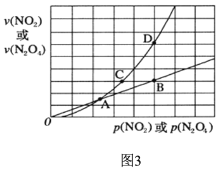
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。

(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。

其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为![]()
B.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
D.某电池的总反应为Fe+2Fe3+=3Fe2+,当有5.6gFe溶解时电路中有0.2mol e-通过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com