
| A、n<0.1mol |
| B、n=0.1mol |
| C、0.1mol<n<0.15mol |
| D、无法确定 |
| 4.48L |
| 22.4L/mol |
| 13.2g |
| 44g/mol |
|


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
| A、O2和O3互为同位素 |
| B、O2和O3的相互转化是物理变化 |
| C、在相同的温度与压强下,等体积的O2和O3含有相同的分子数 |
| D、等物质的量的O2和O3含有相同的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A、B、D、E四种元素所形成的最高价含氧酸中D的酸性最强 |
| B、形成的简单阴离子半径的大小顺序为:C>B>D>E |
| C、D、E、F三种元素形成的单质中都含有共价键 |
| D、1 mo1A、B、C元素的简单氢化物中都含有10 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
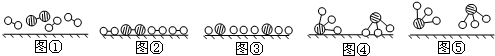
 、
、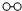 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面.分别写出图②→③、图③→④表示的变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、转移的电子数是1.204×1022 |
| B、阳极上产生112mLO2(标准状况) |
| C、溶液的浓度变化为0.08mol?L-1 |
| D、反应中有0.01molAg被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4.6mol/L |
| B、3.2mol/L |
| C、2.5mol/L |
| D、1.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、电解转移3mol e-时,理论上可制得KIO3 107 g |
| B、电解时,石墨作阳极,不锈钢作阴极 |
| C、电解时的阳极电极反应式:I--6e-+3H2O═IO3-+6H+ |
| D、电解过程中电解质溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com