
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.5mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+2Y2(气)?Z(气)
开始(mol/L):0.2 0.3 0.3
变化(mol/L):0.15 0.3 0.15
平衡(mol/L):0 05 0 0.45
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+2Y2(气)?Z(气),
开始(mol/L):0.2 0.3 0.3
变化(mol/L):0.3 0.6 0.3
平衡(mol/L):0.5 0.9 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0.05<c(X2)<0.5,0<c(Y2)<0.9,0<c(Z)<0.45,若X2浓度为0.3,则X2变化浓度为0.3-0.2=0.1,所以Z的变化浓度应该为0.1,所以最终Z的浓度为0.2,故B错误.
故选D.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


科目:高中化学 来源: 题型:填空题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.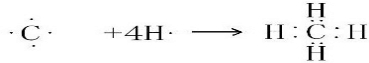 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子量逐渐增大 | B. | 核外电子排布呈周期性变化 | ||
| C. | 核电荷数逐渐增大 | D. | 元素化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
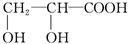 乙:
乙: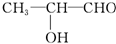
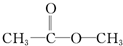 丁:
丁: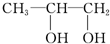
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列实验操作能达到实验目的是(必要时可加热)( )
下列实验操作能达到实验目的是(必要时可加热)( )| 甲 | 乙 | 丙 | 实验目的 | |
| A | 2mL10%的NaOH溶液 | 4-6滴2%的CuSO4溶液 | 0.5mL葡萄糖溶液 | 验证葡萄糖具有氧化性 |
| B | 2mL0.1mol/LAgNO3溶液 | 3滴0.1mol/LNaCl溶液 | 3滴0.1mol/LNaI溶液 | 验证AgCl可转化为溶解度更小的AgI |
| C | FeCl3溶液 | KSCN溶液 | 少量KCl固体 | 验证浓度对化学平衡的影响 |
| D | 3mL无水乙醇 | 2mL乙酸 | 2ml浓硫酸 | 配制反应液以制备乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度一定小于CD的溶解度 | |
| B. | 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| C. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,此反应能够进行是因为碳的还原性比硅强 | |
| D. | 弱酸也可以通过复分解反应制强酸,如:H2S+CuSO4=H2SO4+CuS↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com