
【题目】按要求回答下列问题:
(1)中药肉桂中含有有机物A,其球棍模型为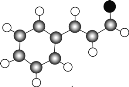 (分子中只含有C、H、O)。则有机物A的结构简式:____________,分子中含有的官能团名称是____________。
(分子中只含有C、H、O)。则有机物A的结构简式:____________,分子中含有的官能团名称是____________。
(2)按系统命名法给有机物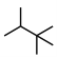 命名:_________________。
命名:_________________。
(3)a、苯酚;b苯甲醇;c、苯甲酸;d、碳酸 四种物质均含有羟基
①写出羟基的电子式___________;
②写出苯酚的电离方程式________________;
③上述4种物质酸性由强到弱的顺序为_______________(填字母)。
(4)写出下列反应的化学方程式
①乙炔与氢气用镍作催化剂在加热条件下反应生成乙烷_________________。
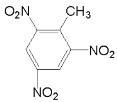
②甲苯制TNT_____________________。
③乳酸在一定条件下生成聚乳酸________________________。
④2分子甘氨酸脱去2分子水_______________________。
【答案】![]() 碳碳双键、醛基 2,2,3-三甲基丁烷
碳碳双键、醛基 2,2,3-三甲基丁烷 ![]() C6H5OH
C6H5OH![]() C6H5O-+H+ cdab CH≡CH+2H2
C6H5O-+H+ cdab CH≡CH+2H2![]() CH3CH3
CH3CH3 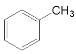 +3HNO3
+3HNO3![]()
 +3H2O
+3H2O 
![]()
 +(n-1) H2O 2H2NCH2COOH→[HNCH2CO]2+2H2O
+(n-1) H2O 2H2NCH2COOH→[HNCH2CO]2+2H2O
【解析】
(1)有机物A,其球棍模型为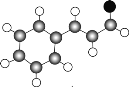 (分子中只含有C、H、O),依据碳氢氧的成键特点,可以推出其结构简式是
(分子中只含有C、H、O),依据碳氢氧的成键特点,可以推出其结构简式是![]() ,分子中含有的官能团是碳碳双键、醛基;
,分子中含有的官能团是碳碳双键、醛基;
(2)有机物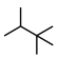 ,最长碳链有四个碳原子,二号碳原子上有两个甲基,三号碳原子上有一个甲基,其名称是2,2,3-三甲基丁烷;
,最长碳链有四个碳原子,二号碳原子上有两个甲基,三号碳原子上有一个甲基,其名称是2,2,3-三甲基丁烷;
(3)①羟基的电子式是![]() ;
;
②苯酚是弱电解质,其电离方程式是C6H5OH![]() C6H5O-+H+;
C6H5O-+H+;
③苯甲酸能与碳酸钠反应生成二氧化碳,酸性比碳酸强,二氧化碳能与苯酚钠反应生成苯酚,得出碳酸的酸性比苯酚强,苯甲醇不能电离,所以酸性强弱是苯甲酸大于碳酸,碳酸大于苯酚,苯酚大于苯甲醇,即酸性由强到弱的顺序为cdab;
(4)①乙炔与氢气用镍作催化剂在加热条件下反应生成乙烷,其化学方程式是CH≡CH+2H2![]() CH3CH3;
CH3CH3;
②甲苯与浓硫酸、浓硝酸的混合酸制TNT,其化学方程式是 +3HNO3
+3HNO3![]()
 +3H2O;
+3H2O;
③乳酸含有羟基和羧基,发生缩聚反应生成高聚物和水,其化学方程式是:
![]()
 +(n-1) H2O;
+(n-1) H2O;
④2分子甘氨酸脱去2分子水其化学方程式是2H2NCH2COOH→[HNCH2CO]2+2H2O。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.1mol·L-1H2X溶液中滴入0.1mol·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-1gc水(OH-)]与所加NaOH溶液体积的关系如图所示。

下列说法中正确的是
A. 水的电离程度:M>N=Q>P
B. 图中M、P、Q三点对应溶液中![]() 相等
相等
C. N点溶液中c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
D. P点溶液中c(OH-)=c(H+)+c(HX-)+c(H2X)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源。
(1)水是制取H2的常见原料,下列有关水的说法正确的是______.
a.水分子是一种极性分子,水分子空间结构呈直线型
b.1个H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
c.水分子间通过H﹣O键形成冰晶体
d.冰晶胞中水分子的空间排列方式与干冰晶胞类似
(2)氢气的安全贮存和运输是氢能应用的关键。
①最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(如图1所示),每个平面上下两侧最多可存10个H2分子.分子中C原子的杂化轨道类型为______,C16S8中σ键与π键之比为______,C16S8与H2微粒间的作用力是______。
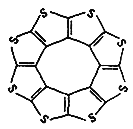
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(用“→”表示)的氨硼烷的结构式_____;与氨硼烷互为等电子体的有机小分子是___(写结构简式)。
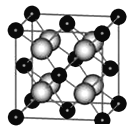
③某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进人到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图)的结构相似,该晶体储氢后Cu:Au:H为______。
④MgH2是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为______________cm3(用含a、NA的代数式表示,NA表示阿伏伽德罗常数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨属于空气污染物,二氧化硫(![]() )的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降到热电厂附近的雨水进行实验。
)的含量是空气质量监测的一个重要指标。某兴趣小组同学取刚降到热电厂附近的雨水进行实验。
a.测得该雨水样品的![]() 为4.73;
为4.73;
b.向雨水样品中滴加![]() 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
c.每隔1h,通过![]() 计测定雨水样品的
计测定雨水样品的![]() ,测得的结果如下表:
,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的 | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题。
(1)正常雨水的![]() 为5.6,偏酸性,这是因为________。
为5.6,偏酸性,这是因为________。
(2)分析上述数据变化,你认为形成这一变化的原因是_________。
(3)该兴趣小组同学取某一时段的这种雨水VL,加入![]() 的
的![]() 溶液至不再产生沉淀时,恰好消耗
溶液至不再产生沉淀时,恰好消耗![]()
![]() 溶液。请计算:
溶液。请计算:
①该VL雨水中溶解![]() 的体积(标准状况)为_______。
的体积(标准状况)为_______。
②生成沉淀物的质量m的范围为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学利用下图所示装置在实验室制备乙酸乙酯
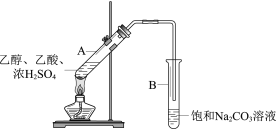
(1)实验中饱和Na2CO3溶液的作用是__________。
(2)分离出试管B中油状液体用到的主要仪器是_________________。
(3)乙醇和乙酸反应制乙酸乙酯是可逆反应。请根据化学平衡移动的相关知识写出一种增大乙酸乙酯产率的方法_________________。
(4)工业上用CH2=CH2和乙酸直接反应获得乙酸乙酯
①其反应类型是____。
②与实验室制法相比,工业制法的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
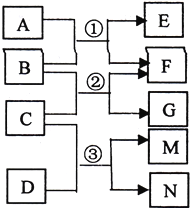
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
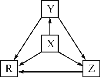
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA﹣)、pC(A2﹣)变化如图所示,下列说法正确的是

A.随着pH的增大,pC增大的曲线是A2﹣的物质的量浓度的负对数
B.pH=3.50时,c(HA﹣)> c(H2A) > c(A2﹣)
C.b点时c(H2A)·c(A2﹣)/c2(HA﹣)=10﹣4.5
D.pH=3.00~5.30时,c(H2A)+c(HA﹣)+c(A2﹣)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地有一池塘,之前生长着丰富的水生生物。近来,由于化工厂将大量污水排入池塘中,使水质恶化,各种水生生物先后死亡。根据题意回答下列问题:
(1)从生态平衡角度看,池塘的这种变化说明了__________________________________,造成这种变化的原因是_____________________________________________________________________。
(2)经检测,污水中溴单质的浓度为![]() ,可用
,可用![]() 除去污水中的溴,发生反应的化学方程式为________________。处理5L这种污水,需加入________L
除去污水中的溴,发生反应的化学方程式为________________。处理5L这种污水,需加入________L![]() 的
的![]() 溶液才能将溴全部除去。
溶液才能将溴全部除去。
(3)要使池塘恢复本来面目,首先要解决的问题是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com