
分析 (1)NH4Cl为强酸弱碱盐,其溶液呈酸性;
(2)Al2(SO4)3水解显酸性,不能放在铁桶中;碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(3)NaHSO3既水解又电离,以电离为主;
(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
解答 解;(1)NH4Cl为强酸弱碱盐,其溶液呈酸性,离子方程式为NH4++H2O?NH3•H2O+H+,
故答案为:酸性;NH4++H2O?NH3•H2O+H+;
(2)Al2(SO4)3水解显酸性,不能放在铁筒中,所以玻璃筒内盛装Al2(SO4)3;碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al2(SO4)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)NaHSO3既水解又电离,HSO3-的电离程度大于水解程度,电离显酸性,所以溶液显酸性;
故答案为:酸性;HSO3-的电离程度大于水解程度;
(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
点评 本题考查盐类水解的分析判断、Ksp的计算,根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子,掌握基础是关键,题目较简单..


科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 | 含有Fe2+ |
| 步骤②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液变为蓝色 | 含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种或以上气体 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
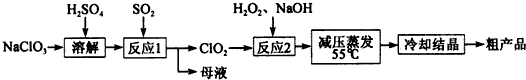
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | B. | c(Na+)=2c(SO32-)+c(HSO3-) | ||
| C. | c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | D. | c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
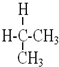 与
与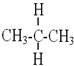 互为同分异构体
互为同分异构体 与
与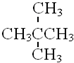 属于同系物
属于同系物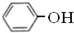 与
与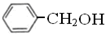 既不是同系物也不是同分异构体.
既不是同系物也不是同分异构体.| A. | ①⑤ | B. | ①④ | C. | ①③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
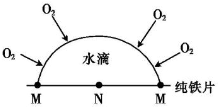
| A. | 纯铁的腐蚀属于电化学腐蚀 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为Fe-3e-═Fe3﹢ | |
| C. | 海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 | |
| D. | 在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 | B. | 12 | C. | 48 | D. | 100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com