
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图:
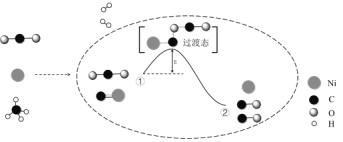
下列说法中错误的是( )
A.过程①→②是吸热反应
B.Ni是该反应的催化剂
C.过程①→②既有碳氧键的断裂,又有碳氧键的形成
D.反应的总化学方程式可表示为:CH4+CO2![]() 2CO+2H2
2CO+2H2
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、社会、科技关系密切。下列解释正确的是![]()
![]()
A.夏天雷雨过后空气清新的主要原因是放电时![]() 和
和![]() 合成了NO
合成了NO
B.加碘盐中添加的是![]()
C.“碳海绵”吸收泄漏的原油时发生了化学变化
D.二氧化硫有毒,不能作为食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是( )

A. 一元酸HA为弱酸
B. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
C. pH=7时,c(Na+)>c(A-)+c(HA)
D. b点所示溶液中c(H+)-c(OH-)=1/2[c(A-)-c(HA)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈____(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____;实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以_____(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应____。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是____。
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。 |
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。 |
C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。 |
D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。 |
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰氧基胡椒酚乙酸酯(F)具有抗氧化性、抗肿瘤作用,其合成路线如下:
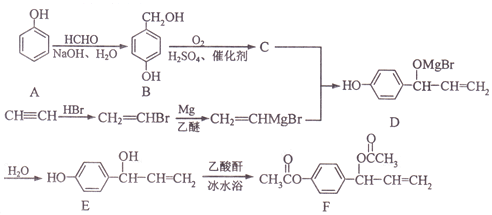
已知:RMgBr![]()
(1)化合物F中含氧官能团的名称为______。
(2)A-B的反应类型为_______。
(3)化合物C的结构简式为______。
(4)1mol化合物E与足量乙酸酐[(CH3CO)2O]反应,除F外另一产物的物质的量为_______。
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱显示有4种不同化学环境的氢,其峰面积比为6:2:1:1。
(6)请以甲苯和乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法转化CO2可实现CO2资源化利用。电解CO2制甲酸盐的装置如图所示。下列说法中错误的是( )
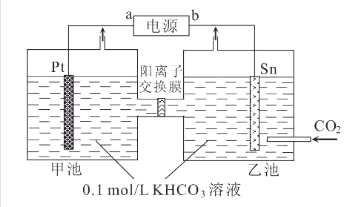
A.b是电源负极
B.K+由乙池向甲池迁移
C.乙池电极反应式为:CO2+HCO3-+2e-=HCOO-+CO32-
D.两池中KHCO3溶液浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5 mol·L-1 MgCO3的饱和溶液中c(Mg2+)为2.6×10-3 mol·L-1。若在5 mL浓度均为0.01 mol·L-1的CaCl2和MgCl2溶液中,逐滴加入5 mL 0.012 mol·L-1 Na2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A.25℃时,Ksp(CaCO3)=2.8×10-9
B.加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C.滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO32-)>c(OH-)
D.滤液M中:![]() =
=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸的尾气中含有一定量SO2,处理尾气的手段除了氨吸收法以外还有以下几种方法。
(一)工业实际吸收过程中,第Ⅰ步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氟化后制得产品A。
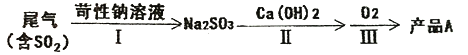
(1)产品A是_______(填化学式)。
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?_______(填“可以”、“不可以”或“不确定”)原因是_______。
(二)制备MnSO4H2O:SO2还原MnO2矿制备MnSO4H2O,过程如下:

己知25℃时部分物质的溶度积常数如下表:
物质 | Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | MnS | FeS | CuS |
溶度积 | 2.1×10-13 | 4.0× 10-38 | 2.2×10-23 | 1.0×10-11 | 6.3×10-18 | 6.3×10-38 |
(3)还原时,若尾气中SO2含量为4.48%,除去标况下lm3尾气至少需要含锰质量分数为55%的MnO2 矿粉_______g。
(4)除铁时加入碳酸钙,发生的反应的离子反应方程式为_____________________。
(5)试剂A最好是______________(写化学式)。
(6)操作I的名称为_________________。MnSO4H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com