
【题目】将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
【答案】C
【解析】
CO2先与OH-发生反应:2OH-+CO2=CO32-+H2O,Ca2+与CO32-反应:Ca2++CO32-=CaCO3↓,因此认为Ca(OH)2先与CO2反应,其次为NaOH,然后是NaAlO2,逐步分析;
CO2先与OH-发生反应:2OH-+CO2=CO32-+H2O,Ca2+与CO32-反应:Ca2++CO32-=CaCO3↓,因此认为Ca(OH)2先与CO2反应,其次为NaOH,然后是NaAlO2,发生的反应依次是Ca(OH)2+CO2=CaCO3↓+H2O、2NaOH+CO2=Na2CO3+H2O、2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓,Na2CO3+CO2+H2O=2NaHCO3、CaCO3+CO2+H2O=Ca(HCO3)2,因此通入CO2与沉淀关系的图像是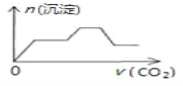 ,故答案选C;
,故答案选C;
答案选C。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】品牌膨松剂中发挥作用的物质为碳酸氢钠。某化学兴趣小组利用下列有关装置,加热该膨松剂样品,通过放出气体的量来检验其品质。

(1)装置D仪器的名称是_________。
(2)装置E中所盛试剂为____________,其作用是______________。
(3)装置的连接顺序为_____________(填装置序号)。
(4)实验过程中,装置A中发生反应的化学方程式为________________。
(5)实验过程中必须向装置内通入空气,装置C的作用是除去空气中的________(填化学式)。加热前,通入一段时间空气的具体操作为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素均不是稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )

A. 原子半径:W>Z
B. 气态氢化物的稳定性:W>X
C. W的最高正化合价与负化合价的绝对值可能相等
D. Z的最高价氧化物的水化物可能为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸,它们都是常见的重要化工原料。
(1)上述物质中,氢元素的质量分数最大的是______填分子式;
(2)分别写出⑦、⑧中所含官能团的名称____________、____________二者发生酯化反应的化学方程式为_________________________________________________,如果用4.6g乙醇和9.0g乙酸充分反应制得乙酸乙酯5.28g,则本实验的产率是:__________产率指的是目标生成物的实际产量与理论产量的比值。
(3)上述物质中,能发生加成反应的烃类物质有:__________________________填序号。
(4)下列物质中,不能通过乙烯加成反应得到的是______填序号。
a.CH3CH3b.CH3CHCl2c.CH3CH2Br
(5)苯、甲苯、二甲苯是用途广泛的有机溶剂。二甲苯的结构有______种,其中一种被称为“PX”,它的一氯代物只有两种,则“PX”的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )

A. 1∶1∶2B. 2∶2∶1
C. 1∶2∶2D. 9∶2∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)Na3AlF6是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用HF、Na2CO3和Al(OH)3制备冰晶石。化学反应原理是,2Al(OH)3+3Na2CO3+12H=2Na3AlF6+3CO2↑+9H2O.属于盐的有Na2CO3和_______。上述反应不能在玻璃容器中反应,其原因是________(用化学方程式表示)。
(2)明矾[KAl(SO4)2·12H2O]常作净水剂。在明矾溶液中滴加氢氧化钡溶液至Al3+恰好完全沉淀,写出该反应的离子方程式____________。
(3)铝合金广泛用于建筑材料。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等(同温同压)。则该合金中铁、硅的质量之比为______。(已知:Si+2NaOH+H2O=Na2SiO3+ 2H2↑)
(4)铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。
①写出化学方程式________________。
②在化学上,含氢还原剂的还原能力用“有效氢”表示,”有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般地含氢还原剂的氢被氧化成H2O,“还原能力”用氢失去电子数多少表示。NaAlH4、NaH的“有效氢”之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是
A. 将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液
B. 将少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液
C. 将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2(g)
D. 将少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入过量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )

A. A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若a小于5,则A、B都是弱酸,且A的酸性弱于B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和 铜片中无杂质,气体体积已转换为标准状况。下列说法正确的是 ( )

A. a 电极的电极材料是铜
B. 如果将稀硫酸换为 CuSO4 溶液,则不能达到实验目的
C. 锌与稀硫酸反应时放出的热量对实验测定不产生影响
D. 若量筒中收集到 a L H2,则电解质溶液中通过了![]() mol 电子
mol 电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com