
【题目】(1)向含有Cr2O72-的酸性废水中滴加硫酸亚铁溶液生成Cr3+,反应的离子方程式为____
(2)FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2 该反应配平后FeO·Cr2O3与NaNO3的系数比为________________。
Na2CrO4+Fe2O3+CO2+NaNO2 该反应配平后FeO·Cr2O3与NaNO3的系数比为________________。
(3)FePO4、Li2CO3、H2C2O4混合后高温煅烧制LiFePO4的化学方程式为_____________
(4)用NaOH、H2O2的混合溶液吸收ClO2生产NaClO2,氧化剂与还原剂的物质的量之比为________。
【答案】Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O 2∶7 2FePO4+H2C2O4+Li2CO3![]() 2LiFePO4+3CO2↑+H2O 2∶1
2LiFePO4+3CO2↑+H2O 2∶1
【解析】
(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,根据电子得失守恒配平。
(2)该反应为氧化还原反应,据电子守恒、原子守恒配平。
(3)FePO4、Li2CO3、H2C2O4混合后高温煅烧制LiFePO4是氧化还原反应,据电子守恒、原子守恒书写配平方程式。
(4)用NaOH、H2O2的混合溶液吸收ClO2生产NaClO2,ClO2为氧化剂,H2O2为还原剂,据电子守恒确定二者物质的量之比。
(1)二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为:
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
(2)Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,反应为2FePO4+H2C2O4+Li2CO3![]() 2LiFePO4+3CO2↑+H2O,则FeO·Cr2O3与NaNO3的系数比为2:7,
2LiFePO4+3CO2↑+H2O,则FeO·Cr2O3与NaNO3的系数比为2:7,
故答案为:2:7;
(3)FePO4、Li2CO3、H2C2O4混合后高温煅烧制LiFePO4,是氧化还原反应,铁元素化合价降低,草酸中碳元素化合价升高生成二氧化碳,写出方程式,根据电子守恒、原子守恒配平后方程式为:2FePO4+H2C2O4+Li2CO3![]() 2LiFePO4+3CO2↑+H2O,
2LiFePO4+3CO2↑+H2O,
故答案为:2FePO4+H2C2O4+Li2CO3![]() 2LiFePO4+3CO2↑+H2O;
2LiFePO4+3CO2↑+H2O;
(4)用NaOH、H2O2的混合溶液吸收ClO2生产NaClO2,ClO2为氧化剂,还原产物为NaClO2,化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,每摩尔H2O2得到2mol电子,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1,
故答案为2:1;


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、M、W的原子序数依次递增,X的简单阴离子与He原子具有相同的电子层结构,Y基态原子未成对电子数在所处周期中最多,M是地壳中含量最多的金属元素,W原子最外层电子数是K层电子数的3倍,Z、W同主族。
(1)下列说法正确的是______。
A.原子半径:![]()
B.X、Y、Z三种元素只能形成共价化合物
C.W的简单气态氢化物的热稳定性比Z的强
D.M的单质能溶于W的最高氧化物对应水化物的稀溶液
(2)X、Y、Z、M、W五种元素中:
①电负性最小的元素是______![]() 填元素的符号,下同
填元素的符号,下同![]() ,第一电离能最大的元素是______。
,第一电离能最大的元素是______。
②Z原子的电子排布图![]() 轨道表示式
轨道表示式![]() 为______,W的电子排布式为______。
为______,W的电子排布式为______。
③如图可以表示Y单质分子中电子云重叠方式的是______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
1molY单质分子中含有![]() 键的数目为______。
键的数目为______。
④Y的简单气态氢化物极易溶于水,其原因是______;一种含碳元素的阴离子R与Y的简单气态氢化物互为等电子体,写出R的电子式:______。
⑤向W的简单气态氢化物的水溶液中通入Z的单质,有W的单质析出,可以验证Z的非金属性强于W,该反应的离子方程式为______。
(3)向含有M简单离子的溶液中加入过量NaOH溶液,可生成![]() 。
。
①不考虑空间构型![]() 要标出配位键,M要用元素符号表示
要标出配位键,M要用元素符号表示![]() ,
,![]() 的结构可用示意图表示为______。
的结构可用示意图表示为______。
②![]() 的空间构型为______,其M原子轨道的杂化类型为______。
的空间构型为______,其M原子轨道的杂化类型为______。
(4)铁、铜和Y元素可生成晶胞结构图1所示的化合物,该化合物的化学式为______。
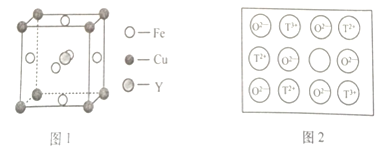
![]() 天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷
天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷![]() 如图2所示
如图2所示![]() 。
。
①基态![]() 的外围电子排布式为______;若该T的氧化物晶体中每有1个
的外围电子排布式为______;若该T的氧化物晶体中每有1个![]() 空缺,则应有______个
空缺,则应有______个![]() 倍
倍![]() 所取代,才能使晶体仍呈电中性。
所取代,才能使晶体仍呈电中性。
②若某T的氧化物晶体样品中![]() 与
与![]() 的离子数之比为1:11,则该晶体的化学式为______。
的离子数之比为1:11,则该晶体的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将![]() mol
mol![]() 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
A.加入50mL1![]() ,反应结束后,
,反应结束后,![]()
B.加入![]() molCaO,溶液中
molCaO,溶液中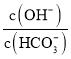 减小
减小
C.加入50mL![]() ,由水电离出的
,由水电离出的![]() 增大
增大
D.加入![]() mol
mol![]() 固体,反应完全后,溶液呈中性
固体,反应完全后,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
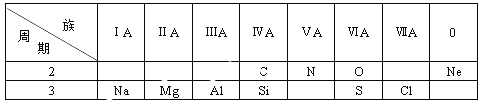
(1)金属性最强的元素是___________;
(2)最外层电子数为8的原子是___________;
(3) O和S二者原子半径较大的是___________;
(4)可用于制造光导纤维的氧化物是___________;
(5)CH4和SiH4二者热稳定性较强的是___________;
(6)MgO和Al2O3中,能与强碱溶液反应的是_____________;
(7)NaOH和Mg(OH)2中,碱性较弱的是___________;
(8)NO在空气中会变成红棕色的NO2,写出该反应的化学方程式___________;
(9)HClO4中氯元素的化合价是______;1mol HClO4含有_________mol O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式________________________________
(2)过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式_________;氧化产物与还原产物的物质的量之比为________。
(3)除去废液中的AsCl3,是用次磷酸钠(NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应的化学反应方程式为______________________氧化剂和还原剂的物质的量之比为________,氧化产物是________。
(4)FeS被水溶液中Cl2氧化,氧化后的溶液中滴加BaCl2有不溶解于盐酸的白色沉淀生成,则水溶液中FeS与Cl2反应的离子方程式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答:
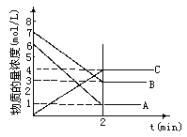
(1)反应物是__________;.
(2)2min内A的平均速率是________;
(3)写出化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各电解质溶液的分析正确的是( )
A.硫酸铁溶液中能大量共存的离子:K+、Na+、NO3-、CO32-
B.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.0.1molL﹣1Na2S溶液中存在:c(OH-)=c(H+)+c(HS﹣)+2c(H2S)
D.NH4HSO4溶液呈酸性的主要原因是:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 有机化合物中每个碳原子最多形成4个共价键
B. 乙烯能使酸性高锰酸钾溶液和溴水褪色,但二者反应原理不相同
C. 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
D. 乙烯和苯均能发生氧化反应,说明乙烯和苯分子中均有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A. NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
B. CuCl2![]() Cu(OH)2
Cu(OH)2![]() Cu
Cu
C. Al![]() NaAlO2(aq)
NaAlO2(aq) ![]() NaAlO2(s)
NaAlO2(s)
D. MgO(s)![]() Mg(NO3)2(aq)
Mg(NO3)2(aq)![]() Mg(s)
Mg(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com