
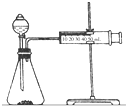
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
分析 实验一:(1)根据表中数据可知,硫酸的浓度相同,不同金属的规格相同,说明实验目的是探究反应物本身对反应速率的影响;影响反应速率的还有温度,做对比实验时只能改变一个条件,其它条件必须相同;
(2)根据图示装置及选取的试剂可知,实验目的是通过测定反应生成氢气快慢进行判断浓度对反应速率的影响;
实验二:(1)影响反应速率的因素除了浓度、温度外,催化剂也影响反应速率;
(2)根据反应方程式可知,反应产物中锰离子随着反应的进行,浓度变化较大,反应前加入硫酸锰,根据反应速率大小判断锰离子是否在该反应中起到催化作用.
解答 解:实验一:(1)根据表中的信息得出该同学的实验目的是研究反应物本身的性质对反应速率的关系对反应速率的影响;温度对化学反应速率的影响较大,故根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度相同;
故答案为:探究反应物本身的性质对反应速率的影响;温度相同;
(2)根据装置图可知,该实验目的是通过测量生成气体的量来研究浓度对反应速率的影响,用大小形状相同的Fe分别和0.5mol/L 及2mol/L的足量稀硫酸反应,通过测定和比较同时间内产生氢气的体积,可以说明浓度对化学反应速率的影响,
故答案为:测定和比较同时间内产生氢气的体积;
实验二:(1)对化学反应速率影响最快的是催化剂,故猜想还可能是催化剂的影响,故答案为:Mn2+的催化作用;
(2)反应方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择的可以做催化剂的试剂应该含有锰离子,故选B.
点评 本题考查了探究影响化学反应速率的因素,注意做对比实验时只能改变一个条件,其它条件必须相同,否则无法得出正确结论.


科目:高中化学 来源: 题型:选择题
| A. | 1771年,法国科学家拉瓦锡发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系 | |
| B. | 化学科学与其他科学分支的联系不密切 | |
| C. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
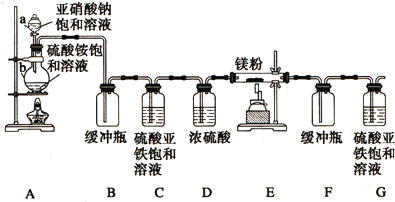
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
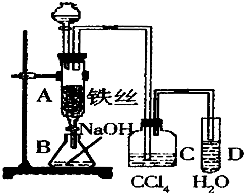 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其密度之比等于物质的量之比 | |
| B. | 其密度之比等于摩尔质量之比 | |
| C. | 等质量的三种气体,其体积比等于相对分子质量之比 | |
| D. | 等体积的三种气体,其物质的量之比等于相对分子质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1 390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com