
| A. | 8:3 | B. | 3:8 | C. | 2:3 | D. | 1:3 |
分析 反应8NH3+3Cl2=N2+6NH4Cl中,N元素化合价升高,由-3价升高到0价,Cl元素化合价降低,由0价降低到-1价,氧化还原反应中,氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等,也可根据化合价的变化结合方程式判断,以此解答该题.
解答 解:反应8NH3+3Cl2=N2+6NH4Cl中,N元素化合价升高,由-3价升高到0价,Cl元素化合价降低,由0价降低到-1价,
由方程式可知当有3molCl2参加反应时,有8molNH3参加反应,其中有2mol被氧化,
被氧化的物质与被还原的物质的分子数之比为2:3,
故选C.
点评 本题考查氧化还原反应,为高频考点,侧重于学生分析、计算能力的考查,注意从元素化合价变化的角度认识氧化还原反应中相关概念和物质的性质,题目难度不大.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
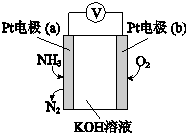
| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极b移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Mg | ||
| C. | Na | D. | 三者产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

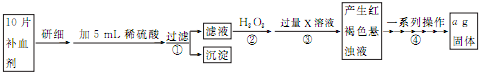

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s | B. | 2s | C. | 4.4s | D. | 1.33s |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第三周期元素的离子半径从左到右依次减小 | |
| B. | HCl、PCl5、N2、CO2分子中所有原子都满足最外层8电子的结构 | |
| C. | 晶体内可以不存在化学键,也可以同时存在离子键和共价键 | |
| D. | 若某离子化合物X2Y3中X3+和Y2-的电子层结构相同,则X、Y两元素的原子序数之差可能是5、15或29 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据右图回答下列问题:
根据右图回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com