
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A |
| 一 | ① | | |||||
| 二 | ② | ③ | ④ | | ⑤ | ⑥ | |
| 三 | | ⑦ | ⑧ | | | ⑨ | ⑩ |
 (1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;
(1)写出元素⑤原子的核外电子排布式 ▲ ,⑥与①形成的10电子阴离子的电子式▲ ;

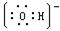 (2).Be(OH)2+2OH-=BeO22-+2H2O
(2).Be(OH)2+2OH-=BeO22-+2H2O ,(1)就可以写出来N :1s22s22p3,⑥与①形成的10电子阴离子就是
,(1)就可以写出来N :1s22s22p3,⑥与①形成的10电子阴离子就是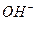 ,所以电子式就为
,所以电子式就为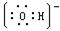 ,(2)不妨先写出
,(2)不妨先写出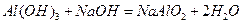 这个方程式,进而写出其离子方程式
这个方程式,进而写出其离子方程式
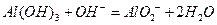 ,这个时候我们只要不
,这个时候我们只要不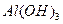 换成Be(OH)2,就可以写出
换成Be(OH)2,就可以写出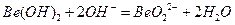 ;(3)元素⑨形成的单质是硫的单质,只存在共价键,也可以说非极性共价键;(4)④的单质晶体熔点为2573K,沸点2823K,硬度大,以上信息可以确定该晶体是原子晶体。NaCl是离子晶体,判断一种晶体是不是离子晶体,就2看其在熔融状态下是否导电。
;(3)元素⑨形成的单质是硫的单质,只存在共价键,也可以说非极性共价键;(4)④的单质晶体熔点为2573K,沸点2823K,硬度大,以上信息可以确定该晶体是原子晶体。NaCl是离子晶体,判断一种晶体是不是离子晶体,就2看其在熔融状态下是否导电。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:不详 题型:单选题
| A.单质的颜色随核电荷数的增加逐渐加深? |
| B.卤化银的溶解度随核电荷数的增加逐渐增大? |
| C.单质与水反应均可表示为X2+H2OHX+HXO? |
| D.随核电荷数的增加,X-的半径递增,还原性递减 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.16 |
| B.17 |
| C.18 |
| D.19 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径X>Y>Z |
| B.离子半径Ym->Xn+>Zm+ |
| C.三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是X,Z,Y |
| D.Y在自然界中没有游离态,可形成原子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
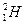 )受控核聚变成氦(
)受控核聚变成氦(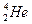 ),下列说法中不正确的是( )
),下列说法中不正确的是( )A.氘(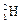 )受控核聚变成氦( )受控核聚变成氦(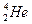 )是不是化学变化 )是不是化学变化 |
| B.“人造太阳”可为人类提供清洁的核聚变能源 |
| C.氘、氚和氕在周期表的位置相同,且原子核内都含有一个质子 |
D.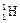 2和 2和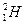 2的物理性质、化学性质都存在着很大的差异 2的物理性质、化学性质都存在着很大的差异 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com