
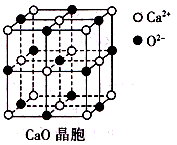
 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,则该配离子的化学式为_______。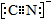 sp杂化
sp杂化 

科目:高中化学 来源:不详 题型:单选题
| A.离子半径:C>D>B>A | B.原子序数:d>c>b>a |
| C.原子半径:A>B>C>D | D.单质的还原性:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | ⑤ | ⑥ | ⑦ | | | | ⑧ | |
| 4 | ⑨ | ⑩ | | | | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y元素位于第2周期 | B.Y、Z均能与X形成不只一种化合物 |
| C.X是ⅤA族元素 | D.氢化物的稳定性:HnZ > HnX |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Z>Y>X |
| B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 |
| C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂 |
| D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com