
分析 25℃时,将0.2mol•L-1的某酸HX逐滴加入到25mL 0.1mol•L-1 NaOH溶液中,恰好完全反应时,所得溶液的pH>7,说明NaX能发生水解,则HX为弱酸;
①当滴加的体积小于12.5mL时,随着HX的滴入,氢氧化钠的浓度减小,对水的电离的抑制程度减小;
②溶液呈中性,则c(Na+)=c(X-),根据Ka=$\frac{c({H}^{+})×c({X}^{-})}{c(HX)}$计算;
③当滴加至25mL时,二者恰好反应,溶液的溶质为NaX,NaX水解显碱性.
解答 解:25℃时,将0.2mol•L-1的某酸HX逐滴加入到25mL 0.1mol•L-1 NaOH溶液中,恰好完全反应时,所得溶液的pH>7,说明NaX能发生水解,则HX为弱酸;
①当滴加的体积小于12.5mL时,随着HX的滴入,氢氧化钠的浓度减小,对水的电离的抑制程度减小,则水的电离程度逐渐增大;
故答案为:逐渐增大;
②溶液呈中性,则c(Na+)=c(X-),c(Na+)=$\frac{0.1×25}{25+15}$=0.0625mol/L,c(HX)=$\frac{0.2×15}{15+25}$-0.0625=0.0125mol/L,
Ka=$\frac{c({H}^{+})×c({X}^{-})}{c(HX)}$=$\frac{1{0}^{-7}×0.0625}{0.0125}$=5×10-7;
故答案为:5×10-7;
③当滴加至25mL时,二者恰好反应,溶液的溶质为NaX,NaX水解显碱性,则离子浓度关系为:c(Na+)>c(X-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(X-)>c(OH-)>c(H+).
点评 本题考查混合后离子浓度的大小比较、电离常数的计算,题目难度中等,考查学生分析和解决问题的能力,明确混合物溶液中的溶质是解答的关键,注意利用物理守恒及酸的强弱等来解答.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应前后氮元素的化合价不变 | |
| B. | 该反应中的四种物质晶体中都存在氢键 | |
| C. | 该反应中NH3、F2、NF3的分子中所有原子均共平面 | |
| D. | 该反应中NH3、F2、NF3三种物质的晶体均属于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| B. | 含有两种官能团 | |
| C. | 1mol该有机物与足量钠反应可得到0.5molH2 | |
| D. | 可以发生取代反应和加成反应,但不能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A,C,D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A,C,D都是有机物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
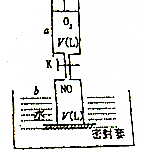 如图所示,活塞的质量与筒壁的摩擦不计,与K相连的细管的体积也忽略不计,在标准状况下:
如图所示,活塞的质量与筒壁的摩擦不计,与K相连的细管的体积也忽略不计,在标准状况下:查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
利用实验器材(规格和数量不限)不能完成相应实验的一项是( )
选项 | 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿、酒精灯 | CuSO4溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸、漏斗 | 用盐酸除去BaSO4中少量BaCO3 |
C | 烧杯、玻璃棒、托盘天平、容量瓶 | 用固体NaCl配制0.5 mol·L-1的溶液 |
D | 烧杯、分液漏斗 | 用CCl4萃取碘水中的碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com