
组成和结构可用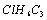
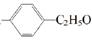 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )
A.10种 B.16种 C.20种 D.25种
科目:高中化学 来源: 题型:
已知下列热化学方程式
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z为短周期内除稀有气体元素外的四种元素。它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W的最外层电子数相等,Y、Z两种元素的质子数之和为W、X两种元素的质子数之和的3倍。由此可知:
(1)元素W为________(填元素符号,下同),X为________,Y为________,Z为________。
(2)上述元素中任意三种组成的既含有离子键又含有共价键的化合物有________________________(填化学式,至少写三种)。
(3)四种元素两两组合,形成的共价化合物有________(填化学式,至少写三种)。
(4)上述四种元素可组成化合物________(填化学式),其中含有的化学键为________键和________键。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
下列说法正确的是( )
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO (g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g)  2NO(g) △H>0 1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
2NO(g) △H>0 1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,能使溶液浓度恢复到电解前浓度的是 ( )
A.NaCl B.Na2CO3 C.CuSO4 D.K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
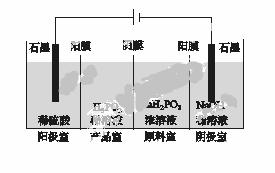
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com