
【题目】某工厂对制革工业污泥中铬的处理工艺流程如下:

已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________________________。
②常温下,当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1mol·L-1)___________ 。 (填“是”或“否”)若要使Mg2+完全沉淀,溶液的pH至少为_________(已知Ksp[Mg(OH)2]=1. 6×10-12,lg2=0.3)。
【答案】升高温度(加热) 搅拌 pH超过8时,会使部分Al(OH)3溶解生成AlO2-,最终影响Cr的回收与再利用 否 10.6
【解析】
(1)酸浸时,为了提高浸取率可采取的措施有加热、搅拌、粉碎、提高酸的浓度等。
(2)①用NaOH调节溶液的pH不能超过8,从沉淀的溶解、产品的提纯等分析。
②常温下,当pH=8时,Mg2+是否开始沉淀,利用Ksp[Mg(OH)2]进行分析。若要使Mg2+完全沉淀,溶液的pH计算,从c(Mg2+)=10-5mol/L进行计算。
(1)酸浸时,为了提高浸取率可采取的措施有升高温度(加热)、搅拌等。答案为:升高温度(加热);搅拌;
(2)①用NaOH调节溶液的pH不能超过8,其理由是pH超过8时,会使部分Al(OH)3溶解生成AlO2-,最终影响Cr的回收与再利用。答案为:pH超过8时,会使部分Al(OH)3溶解生成AlO2-,最终影响Cr的回收与再利用;
②常温下,当pH=8时,c(OH-)=10-6mol/L,1×(10-6)2=10-12<1.6×10-12,则Mg2+没有开始沉淀。若要使Mg2+完全沉淀,c(Mg2+)=10-5mol/L,Ksp[Mg(OH)2]=10-5×c2(OH-)=1.6×10-12,c(OH-)=4×10-4mol/L。溶液的pH=-lg![]() =10.6。答案为:否;10.6。
=10.6。答案为:否;10.6。


科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W 原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z的简单离子半径同周期中最小, W 的价电子数是Z的2倍。下列说法正确的是( )
A.第一电离能:W>Z>Y>X
B.由Y 、W组成的化合物的水溶液呈碱性的原因:W2-+2H2O![]() H2W+2OH-
H2W+2OH-
C.Z的最高价氧化物的水化物的碱性比Y的强
D.由 Z、W 组成的化合物不能在水溶液中制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用滴有酚酞和氯化钠溶液的湿润滤纸分别做甲、乙两个实验,下列判断正确的是

A. b、d两极附近均有气泡冒出
B. 甲乙中变红色的电极均发生了还原反应
C. a、d两极电极反应均为:Fe-2e-=Fe2+
D. 乙中铁棒比甲中铁棒更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,不正确的是![]()
![]()

A.用装置①电解氯化铜溶液,则a为阳极,发生氧化反应
B.装置②为原电池,总反应是:![]()
C.图③所示柱形图,纵坐标表示第二周期元素最高正价随原子序数的变化
D.图④所示曲线,表示该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图1实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体请回答:
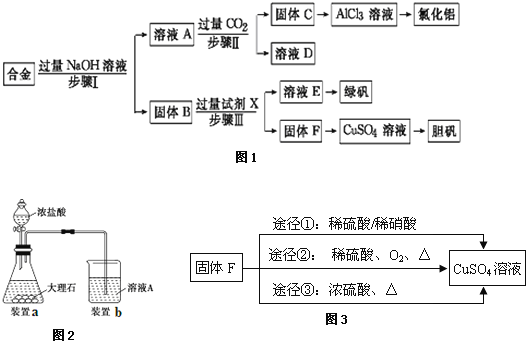
(1)写出步骤Ⅰ反应的离子方程式: ______ 。
(2)试剂X是 ______。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ______。
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是 ______。
(4)由溶液E到绿矾晶体(FeSO47H2O),所需操作是 ______ 、 ______ 、 ______ 、洗涤、干燥。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:写出途径①中反应的离子方程式 ______ ,请选出你认为的最佳途径并说明选择的理由 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
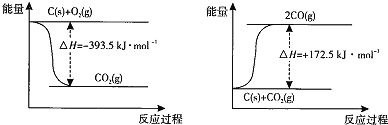
【题目】碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,![]() ______ 。
______ 。
(2)在体积为2L的密闭容器中,充入1mol ![]() 和3mol H,一定条件下发生反应:
和3mol H,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的物质的量随时间变化的曲线如图所示:
的物质的量随时间变化的曲线如图所示:

①从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]() ______ 。
______ 。
②下列措施中能使化学平衡向正反应方向移动的是 ______ ![]() 填编号
填编号![]() 。
。
A.升高温度
![]() 将
将![]() 及时液化移出
及时液化移出
C.选择高效催化剂
![]() 再充入1mol
再充入1mol ![]() 和4mol
和4mol ![]()
(3)![]() 溶于水生成碳酸。已知下列数据:
溶于水生成碳酸。已知下列数据:
弱电解质 |
|
|
电离平衡常数 |
|
|
现有常温下![]() 的
的![]() 溶液,已知:
溶液,已知:![]() 水解的平衡常数
水解的平衡常数![]() ,
,![]() 第一步水解的平衡常数
第一步水解的平衡常数![]() 。
。
①判断该溶液呈 ______ ![]() 填“酸”、“中”、“碱”
填“酸”、“中”、“碱”![]() 性,写出该溶液中
性,写出该溶液中![]() 发生第一步水解的离子方程式 ______ 。
发生第一步水解的离子方程式 ______ 。
②下列粒子之间的关系式,其中正确的是 ______ 。
A.![]()
B.![]()
C.![]()
D.![]()
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和![]() 为原料做成电池。原理如图所示:
为原料做成电池。原理如图所示:
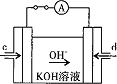
通入CO的管口是 ______ ![]() 填“c”或“d”
填“c”或“d”![]() ,写出该电极的电极反应式: ______ 。
,写出该电极的电极反应式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)= mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+ == Fe2+ + Cu、 、 。
② 试剂B是 。
③ 操作③是蒸发浓缩、冷却结晶、 ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学,与社会、环境等密切相关。下列说法错误的是
A.用![]() 合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
B.用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性
C.浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如图所示:下列说法正确的是( )

A.pH=7.2时,溶液中c(H2PO4ˉ)+c(HPO42-)+c(OHˉ)=c(Na+)+c(H+)
B.曲线1和曲线2分别表示δ(H3PO4)和δ(HPO42-)的变化
C.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L
D.25℃时,H3PO4的电离常数K1=10-2.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com