
【题目】对于反应N2O4![]() 2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。下列说法正确的是
2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。下列说法正确的是
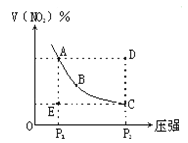
A、A、C两点的正反应速率的关系A>C
B、A、B、C、D、E各状态,V正>V逆的是状态D
C、使E状态从水平方向到达C状态,从理论上来讲,
可选用的条件是从P1突然加压至P2
D、维持P1不变,E→A所需时间为x,维持P2不变,D→C所需
时间为y,则x<y
【答案】C
【解析】
试题分析:A.对于有气体参加的化学反应,压强越大,反应速率越大,由于C点对应的压强大于A点的压强,所以正反应速率A<C,A项错误;B.在图象中,A、B、C三点都在平衡线上,所以此三点的正逆反应速率相等,D点要达到平衡,必须降低NO2的质量分数,也就是使平衡向逆反应方向移动,从而得出v(正)< v(逆),B项错误;C.当快速加压时,平衡未移动,当缓慢加压时,平衡不断地被破坏,但又不断地建立新的平衡,所以“使E状态从水平方向到达C状态”,应突然加压;“由C沿平衡曲线以达A状态”,应缓慢降压,C项正确;D.压强越大反应速率越大,因D点的压强大于E点的,所以D点的反应速率大于E点的反应速率,所需时间x>y,D项错误;答案选C。


科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:1/3Fe2O3(s)+CO(g) ![]() 2/3Fe(s)+CO2 (g),已知该反应在不同温度下的平衡常数如下表,下列说法正确的是
2/3Fe(s)+CO2 (g),已知该反应在不同温度下的平衡常数如下表,下列说法正确的是
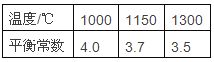
A、△H>0
B、1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2 的物质的量分别为0.5mol、1.8mol,此时反应向正反应方向进行
C、其他条件不变,向平衡体系充入CO 2 气体,K值减小
D、其他条件不变,升高温度,可以提高CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) △H> 0请回答下列问题
P(g)+Q(g) △H> 0请回答下列问题
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol/L,c(N)=2.4mol/L;达到平衡后,M的转化率为60%,此时N的转化率为____________
(2)若反应温度升高,M的转化率 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol/L,c(N)=amol/L;达到平衡后,c(P)=2mol/L,a=____________
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=bmol/L,达到平衡后,M的转化率为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、 向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色。
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O_____________。
(2)只比较上述反应②与③,则判断I2起到了___________的作用。
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
II、一定条件下,向含硝酸的废水中加入CH3OH(碳元素为-2价),将HNO3还原成N2。若参加反应的还原剂和氧化剂的物质的量之比是5∶6,则该反应中被氧化的元素的化合价为_____;每转移3 mol电子,反应消耗_____g CH3OH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl、S、P为三种原子序数相连的元素,则下列说法正确的是( )
A. 气态氢化物的稳定性:HCl>H2S>PH3
B. 非金属活泼性:S<Cl<P
C. 原子半径:Cl>S>P
D. 原子序数:S<P<Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B. 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度缩小
C. 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较
D. 蒸发操作时,蒸发皿必须放在石棉网上,并用酒精灯的外焰加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2=1:3B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为3:2D.c1的取值范围为0<c1<0.14mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,Q与水反应的化学方程式为_____________。
(2)NaCN超标的电镀废水可用两段氧化法处理:
1.NaCN与NaClO反应,生成NaOCN和NaCl
2.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
①写出第二次氧化时发生反应的离子方程式。
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成____________和H2O。
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO_________g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com